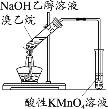
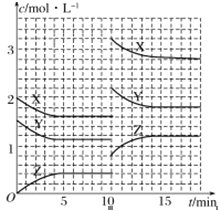
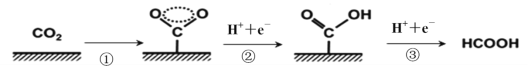
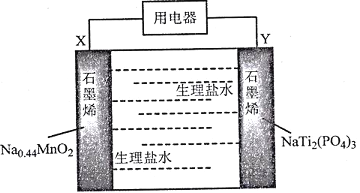
题目内容
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图:
 ΔH=+88.6 kJ/mol,
ΔH=+88.6 kJ/mol,
则M、N相比,较稳定的是_____(用字母“M”或“N”表示)。
(2)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-a kJ/mol,则a_____238.6(填“>”“<”或“=”)。
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g),已知升高温度CO的浓度增大。
Si3N4(s)+6CO(g),已知升高温度CO的浓度增大。
①该反应的焓变ΔH______(填“>”“<”或“=”)0;
②降低温度,其平衡常数值将______(填“增大”“减小”或“不变”);
③增大压强,N2的体积分数将_____(填“增大”“减小”或“不变”)。
【答案】M > > 减少 增大
【解析】
(1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)甲醇为液体,燃烧生成CO2(g)和H2O(l),而物质由气态转化为液态需要放热,据此分析判断;
(3)3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g),升高温度,CO的浓度增大,说明升高温度,平衡正向移动,正反应为吸热反应,据此分析解答。
Si3N4(s)+6CO(g),升高温度,CO的浓度增大,说明升高温度,平衡正向移动,正反应为吸热反应,据此分析解答。
(1)有机物M经过太阳光光照可转化成N,△H=+88.6kJmol-1,是吸热反应,N暗处转化为M,是放热反应,则M的能量比N低,能量越低越稳定,说明M稳定;故答案为:M;
(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇为液体,而气体转化为液体需要放热,因此CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-a kJ/mol,放出的热量大于燃烧热,即a>238.6,故答案为:>;
(3)①3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g),升高温度,CO的浓度增大,说明升高温度,平衡正向移动,正反应为吸热反应,ΔH>0,故答案为:>;
Si3N4(s)+6CO(g),升高温度,CO的浓度增大,说明升高温度,平衡正向移动,正反应为吸热反应,ΔH>0,故答案为:>;
②△H>0,该反应为吸热反应,降低温度,平衡向逆反应移动,化学平衡常数减小,故答案为:减小;
③3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g),正反应是气体体积增大的反应,增大压强,平衡向气体体积减小的方向移动,即向逆反应移动,N2的体积分数将增大,故答案为:增大。
Si3N4(s)+6CO(g),正反应是气体体积增大的反应,增大压强,平衡向气体体积减小的方向移动,即向逆反应移动,N2的体积分数将增大,故答案为:增大。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案