题目内容
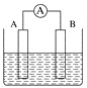
【题目】298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。据此某学习小组设计如图所示的原电池装置。下列有关说法正确的是
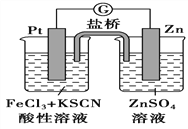
A. 正极反应为Zn-2e-=Zn2+
B. 该电池总反应为3Zn+2Fe3+=2Fe+3Zn2+
C. Pt电极上有气泡出现
D. 左烧杯中溶液的红色变浅
【答案】D
【解析】
金属性锌强于Pt,锌是负极,Pt是正极,结合原电池的工作原理解答。
A、锌是活泼的金属,锌是负极,该原电池的负极反应是Zn-2e-=Zn2+,Pt是正极,正极反应是Fe3++e-=Fe2+,A错误;
B、该电池总反应为Zn+2Fe3+=2Fe2++Zn2+,B错误;
C、铂电极上的反应为Fe3++e-=Fe2+,电极上没有气泡出现,C错误;
D、左烧杯中反应为Fe3++e-=Fe2+,因此溶液的血红色逐渐褪去,D正确。
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目