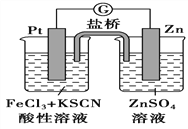
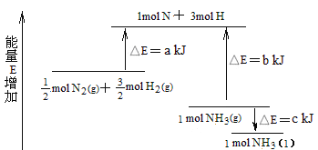
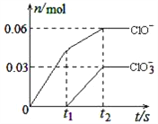
题目内容
【题目】根据题目要求填空:
(1)有SO2、CH3COOH、BaSO4、CH3CH2OH四种物质,属于非电解质的是_________、__________;属于强电解质的是________________;属于弱电解质的是_______________。
(2)写出下列物质在水溶液中电离的方程式
①NaHCO3:__________________________________________;
②HClO:_______________________________________________。
(3) 写出MgCl2的电子式 ___________________________
【答案】SO2 CH3CH2OH BaSO4 CH3COOH NaHCO3=Na+ + HCO3- HClO![]() H++ClO-
H++ClO- ![]()
【解析】
(1)电解质是在水溶液或熔化状态下能够导电的化合物,非电解质是指在水溶液里和熔化状态下都不能导电的化合物,SO2 和CH3CH2OH属于非电解质,强电解质首先属于电解质,强电解质在水溶液里能够完全电离成离子,BaSO4属于强电解质;而弱电解质不能完全电离成离子,CH3COOH属于弱电解质,故答案为:SO2、CH3CH2OH;BaSO4;CH3COOH。
(2)①NaHCO3是强电解质,能够完全电离,电离方程式为:NaHCO3=Na+ + HCO3-,故答案为:NaHCO3=Na+ + HCO3-;
②HClO是弱电解质,部分发生电离,电离方程式为:HClO![]() H++ClO-,故答案为:HClO
H++ClO-,故答案为:HClO![]() H++ClO-。
H++ClO-。
(3)MgCl2由离子键构成,电子式为:![]() ,故答案为:
,故答案为:![]() 。
。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目