题目内容
2.已知工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3~0.5g.已知NaNO2能发生如下反应:2NO2-+2I-+4H+═2NO↑+I2+2H2O,淀粉溶液遇碘单质变蓝色.(1)上述反应氧化剂是NaNO2.NO的收集方法是用排水法收集
(2)根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别NaNO2和NaCl.现供选用的物质有:
①白酒 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋,
进行本实验时,可以选用的物质至少有②⑤(填序号)
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是D(填序号)
A.NaCl B.KMnO4 C.浓硝酸 D.NH4Cl.
分析 (1)氧化还原反应中,化合价降低元素所在的反应物是氧化剂,根据NO与氧气就发生反应生成二氧化氮判断收集方法;
(2)根据反应时有沉淀、气体、颜色变化等明显现象选择试剂;
(3)选择试剂时要考虑:既能使NaNO2转化又无二次污染.
解答 解:(1)2NaNO2+4HI═2NO+I2+2NaI+2H2O,氮元素的化合价降低,所以NaNO2是氧化剂,又NO与氧气就发生反应生成二氧化氮,所以只能用排水法收集NO,
故答案为:NaNO2;用排水法收集;
(2)①水、③淀粉、④白酒与NaNO2都不反应,所以无明显现象;KI与NaNO2反应生成I2必须在酸性条件下才能反应,食醋会电离出微量的氢离子,碘化钾在食醋本身带的溶剂水中电离出碘离子,亚硝酸钠电离出亚硝酸根与钠离子,发生反应生成碘单质,I2使湿润的淀粉碘化钾试纸变蓝,故答案为:②⑤;
(3)NaNO2→N2是被还原,必须加还原剂;N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂.方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,故答案为:D.
点评 本题考查氧化还原反应的配平、计算、基本概念等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
13.下列物质中属于氧化物的是( )
| A. | 高锰酸钾 | B. | 过氧化氢溶液 | C. | 氧气 | D. | 水 |
10.下列有关化学实验操作正确的是( )
| A. |  闻气味 | B. | 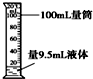 量取液体 | ||
| C. | 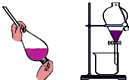 将乙醇与水分离 | D. |  检查装置的气密性 |
17.如图1为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
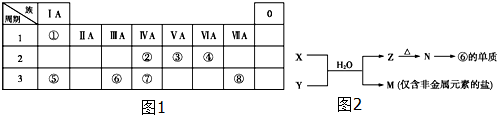
(1)写出由④、⑤、⑧元素形成的既含离子键又含共价键的一种离子化合物的化学式:NaClO.
(2)含元素⑧的单质能与自来水中的有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是AC.
A.ClO2 B.AlCl3 C.K2FeO4
(3)W与④是相邻的同主族元素.在下表中写出H2WO3相应性质的化学方程式.
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生如图2反应:
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;
M中阳离子的鉴定方法是取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH+4)>c(H+)>c(OH-).

(1)写出由④、⑤、⑧元素形成的既含离子键又含共价键的一种离子化合物的化学式:NaClO.
(2)含元素⑧的单质能与自来水中的有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是AC.
A.ClO2 B.AlCl3 C.K2FeO4
(3)W与④是相邻的同主族元素.在下表中写出H2WO3相应性质的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH=Na2SO3+2H2O |
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;
M中阳离子的鉴定方法是取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH+4)>c(H+)>c(OH-).
11.X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M.下列叙述正确的是( )
| A. | M的单质具有两性,所以能与NaOH溶液发生反应生成氢气 | |
| B. | Z、W、M的氧化物均可做耐高温材料 | |
| C. | 工业上常用电解熔融氯化物的方法制备Z、W的单质 | |
| D. | Y的单质都有剧毒,而且其着火点低,常保存在冷水中 |
12.用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1mol甲基(-CH3)含有9NA个电子 | |
| B. | 标准状况下,22.4LSO3含有的原子数为4NA | |
| C. | 0.10mol•L-1NaOH溶液中含有OH1离子数是0.1NA | |
| D. | 5.6Fe与2.24LCl2充分反应转移电子数为0.2NA |
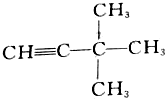 的名称是3,3-二甲基-1-丁炔;
的名称是3,3-二甲基-1-丁炔;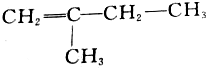 的名称是2-甲基-1-丁烯;
的名称是2-甲基-1-丁烯; ;
;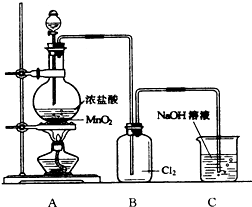 如图是实验室制取氯气的装置图,根据要求填空回答.
如图是实验室制取氯气的装置图,根据要求填空回答.