题目内容
7.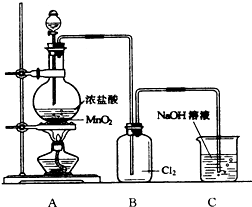 如图是实验室制取氯气的装置图,根据要求填空回答.
如图是实验室制取氯气的装置图,根据要求填空回答.(1)A烧瓶中发生反应的化学方程式是:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)集气瓶B中导气管需要伸入集气瓶底部的原因是氯气的密度比空气的密度大,导管插入瓶底有利于排净空气.
(3)C装置的作用是吸收多余的氯气,防止污染空气.
(4)集气瓶B中的氯气中气中混有的杂质主要是HCl、H2O,要制得纯净干燥的氯气,可采取的措施是将制得的氯气依次通过饱和食盐水和浓硫酸.
分析 (1)二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水;
(2)依据氯气密度大于空气密度解答;
(3)氯气有毒,直接排放能够引起空气污染,能够与碱反应,可以用氢氧化钠吸收过量氯气;
(4)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,依据氯气、氯化氢的水溶性、浓硫酸的吸水性进行除杂.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,化学方程式:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气密度大于空气,所以采用向上排空气法收集,导管插入管底有利于排净空气;
故答案为:氯气的密度比空气的密度大,导管插入瓶底有利于排净空气;
(3)氯气有毒,直接排放能够引起空气污染,能够与碱反应,可以用氢氧化钠吸收过量氯气;
故答案为:吸收多余的氯气,防止污染空气;
(4)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯化氢,浓硫酸具有吸水性能够干燥氯气,要得到干燥的氯气,应先除去氯化氢,再干燥,
故答案为:HCl、H2O;将制得的氯气依次通过饱和食盐水和浓硫酸.
点评 本题考查了气体的制备,熟悉氯气的制备原理是解题关键,注意氯气的收集和除杂、尾气处理的方法,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
2.用NA表示阿伏伽德罗常数的值,下列各物质所含的原子数是2NA的是( )
| A. | 16g H2 | B. | 16g S | C. | 24g Mg | D. | 24g C |
18.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
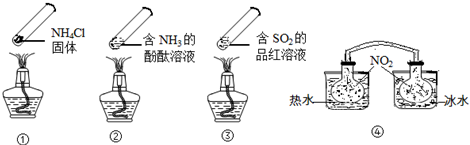

| A. | ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 | |
| B. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| C. | 加热时,②、③溶液均变红,冷却后又都变为无色 | |
| D. | 四个“封管实验”中所发生的化学反应都是可逆反应 |
15.下列有关化学用语表示正确的是( )
①CSO的结构式:S═C═O
②Cl-的结构示意图:
③甲烷分子的比例模型:
④葡萄糖的分子式:C6H12O6
⑤原子核内有10个中子的氧原子${\;}_{8}^{10}$O
⑥HCO3-的水解方程式:HCO3-+H2O?CO3-+H3O+.
①CSO的结构式:S═C═O
②Cl-的结构示意图:

③甲烷分子的比例模型:

④葡萄糖的分子式:C6H12O6
⑤原子核内有10个中子的氧原子${\;}_{8}^{10}$O
⑥HCO3-的水解方程式:HCO3-+H2O?CO3-+H3O+.
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤⑥ | D. | 全部正确 |
12.将一定量的金属钠放入饱和的NaOH溶液中,恢复至原温度.NaOH溶液的物质的量浓度( )
| A. | 不变 | B. | 不能确定 | C. | 减少 | D. | 增大 |
19.下列说法不正确的是( )
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,乙酸乙酯水解、苯与硝酸作用生成硝基苯的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物(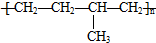 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
16.下列各组离子在相应的条件下一定能大量共存的是( )
| A. | 在碱性溶液中:CO32-、K+、S2-、Na+ | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- | |
| C. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:NH4+、AlO2-、C1-、K+ | |
| D. | 在中性溶液中:Fe3+、C1-、NO3-、A13+ |
17.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| B. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后转移电子的数目为0.6NA | |
| D. | 常温下,1L0.1mol•L-1NH4NO3溶液中的氢原子数为0.4NA |