题目内容
14.某课外兴趣小组欲配制饱和FeCl3溶液来制备Fe(OH)3胶体,并探究其性质:(1)制备100mL饱和FeCl3溶液,所需仪器有托盘天平、玻璃棒、烧杯、量筒、胶头滴管.
在制备的实验当中,若遇到下列情况,对饱和FeCl3溶液的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)?(其他操作准确)
①摇匀后发现液面低于刻度线再加水:偏低
②定容时观察液面俯视:偏高
(2)制备氢氧化铁胶体:首先取少量蒸馏水于洁净的烧杯中,用酒精灯加热至沸腾,向烧杯中逐滴滴加饱和FeCl3溶液继续煮沸,至液体呈透明的红褐色.
①请写出制备Fe(OH)3胶体的离子方程式:Fe3++3H2O?Fe(OH)3+3H+;
②某同学按要求制备了Fe(OH)3胶体,但是他又向Fe(OH)3胶体中逐滴加入了稀硫酸溶液,结果出现了一系列变化.
先出现红褐色沉淀,原因是电解质H2SO4使Fe(OH)3胶体聚沉而产生沉淀,随后沉淀溶解,此反应的离子方程式是Fe(OH)3+3H+=Fe3++3H2O.
分析 (1)实验室配制100mL饱和FeCl3溶液的操作步骤分别是:计算、称量、溶解,根据各操作所需要使用的仪器,判断确定所需的仪器;
分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(2)①三价铁离子水解得到氢氧化铁胶体;
②根据胶体的性质判断,加入稀硫酸产生现象;氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,硫酸和氢氧化铁沉淀反应,生成硫酸铁和水.
解答 解:(1)实验室配制100mL饱和FeCl3溶液的操作步骤分别是:计算、称量、溶解,药匙用于取用FeCl3,托盘天平用于称取固体FeCl3、量筒与胶头滴管用于准确量取水、烧杯用于完成溶解操作、玻璃棒用于溶解时的搅拌,故答案为:量筒;胶头滴管;
①再加水,溶液的体积偏大,溶液的浓度偏低,故答案为:偏低;②定容时观察液面俯视,导致溶液的体积偏小,溶液的浓度偏高,故答案为:偏高;
(2)①制备Fe(OH)3胶体的离子方程式:Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+;
②电解质H2SO4电离出的SO42-使Fe(OH)3胶体发生聚沉,生成红褐色沉淀;继续加入硫酸,会发生酸碱中和反应,生成氯化铁和水,此反应的离子方程式是Fe(OH)3+3H+═Fe3++3H2O,
故答案为:电解质H2SO4使Fe(OH)3胶体聚沉而产生沉淀;Fe(OH)3+3H+═Fe3++3H2O.
点评 本题考查Fe(OH)3胶体的制备知识,注意氢氧化铁胶体的聚沉以及沉淀的溶解原因是解答本题的关键,题目难度不大.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
19.下列说法不正确的是( )
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 在一定条件下,乙酸乙酯水解、苯与硝酸作用生成硝基苯的反应都属于取代反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物(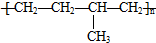 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
4.学好自然科学知识是改造自然的基础.自然科学知识告诉我们,物质的能量越低,该物质越稳定.下列含氮物质中,能量最低的是( )
| A. | 氨气 | B. | 氮气 | C. | 一氧化氮 | D. | 硝酸 |


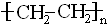 ;
; CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.