题目内容
12.用NA表示阿伏伽德罗常数,下列叙述正确的是( )| A. | 1mol甲基(-CH3)含有9NA个电子 | |
| B. | 标准状况下,22.4LSO3含有的原子数为4NA | |
| C. | 0.10mol•L-1NaOH溶液中含有OH1离子数是0.1NA | |
| D. | 5.6Fe与2.24LCl2充分反应转移电子数为0.2NA |
分析 A、甲基不带电荷;
B、标况下,三氧化硫为固体;
C、溶液体积不明确;
D、氯气的状态不明确.
解答 解:A、甲基不带电荷,故1mol甲基含9mol电子即9NA个,故A正确;
B、标况下,三氧化硫为固体,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故C错误;
D、氯气的状态不明确,不一定是标况,故2.24L氯气的物质的量不一定是0.1mol,则与铁反应时转移的电子的量无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.如图所示的是氢氧燃料电池原理示意图,电解质溶液为中性,按照此图的提示,下列叙述不正确的是( )
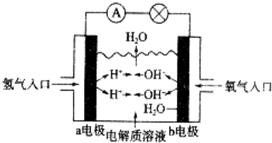

| A. | a电极为负极 | |
| B. | b电极的电极反应式为4OH-→2H2O+O2↑+4e- | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 氢氧燃料电池是一种不需要将氧化剂和还原剂全部储藏在电池内的新型发电装置 |
7.2015年7月31日,中国获得2022年冬奥会主办权,这将促进中国冰雪运动,以下关于冰的说法正确的是( )
| A. | 冰与水共存物属于混合物 | B. | 冰的密度比水大 | ||
| C. | 冰与二氧化硅的晶体类型相似 | D. | 氢键在冰晶体结构中起关键作用 |
17.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| B. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA | |
| C. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后转移电子的数目为0.6NA | |
| D. | 常温下,1L0.1mol•L-1NH4NO3溶液中的氢原子数为0.4NA |
4.学好自然科学知识是改造自然的基础.自然科学知识告诉我们,物质的能量越低,该物质越稳定.下列含氮物质中,能量最低的是( )
| A. | 氨气 | B. | 氮气 | C. | 一氧化氮 | D. | 硝酸 |
2.下列不属于有机物的是( )
| A. | 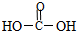 | B. | CCl4 | C. | 蔗糖 | D. | 合成纤维 |

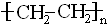 ;
; CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.