题目内容
12.利用氧化还原反应原理配平8NH3+3 Cl2$\frac{\underline{\;催化剂\;}}{△}$1N2+6NH4Cl
在反应中氮元素元素被氧化,NH4Cl是还原产物.当反应中有0.3mol电子发生转移时,生成N2的体积(标准状况)1.12 L.
分析 N在反应前后的化合价分别为-3价和0价,N元素被氧化,每生成1mol氮气,失电子6mol,Cl在反应前后的化合价分别为0价和-1价,NH4Cl是还原产物,每有1mol氯气反应得电子2mol,据氧化还原反应中得失电子守恒和原子守恒配平化学方程式.
解答 解:N在反应前后的化合价分别为-3价和0价,N元素被氧化,每生成1mol氮气,失电子6mol,Cl在反应前后的化合价分别为0价和-1价,NH4Cl是还原产物,每有1mol氯气反应得电子2mol,作还原剂的氨气与氧化剂氯气的物质的量之比为2:3,据Cl原子守恒,则NH4Cl的化学计量数为6,再据N原子守恒,NH3的化学计量数为8,配平后的化学计量数分别为8 3 1 6,每生成1mol氮气,转移电子物质的量为6mol,转移0.3mol电子生成氮气物质的量为0.05mol,标准状况下体积为1.12L,
故答案为:8;3;1;6;氮元素;NH4Cl;1.12.
点评 本题主要考查了氧化还原反应的配平、氧化产物、电子得失守恒的运用,难度不大,注意基础知识的掌握.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
2.含氧酸的元数等于羟基氢的个数,氢氧化钠只能中和连在氧上的羟基氢,磷元素有多种含氧酸,如次磷酸(H3PO2)、亚磷酸(H3P03)、磷酸等,它们分别为一元、二 元、三元弱酸或中强酸.
(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
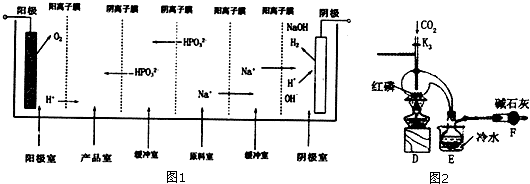
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.
(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
请回答:
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
(1)其中次磷酸钠常用来给腈纶织物进行化学镀,某种碱性化学镀铜试剂的配方有次磷酸钠和硫酸铜,产物中有亚磷酸钠的正盐,请写出相关离子方程式:H2PO2-+Cu2++3OH-=Cu↓+HPO32-+2H2O.
(2)亚磷酸可以由三氯化磷水解得到,也可以由电解亚磷酸钠来制备,如图1是用一个六室电渗析槽制备亚磷酸.其中阳极室和产品室之间的阳离子膜主要目的是防止:2H3PO3+O2=2H3PO4(只要求写出化学方程式),这种方法的产品除了有亚磷酸,还有:氧气、氢气、氢氧化钠,如果去掉右边两个阳离子膜(没有了右边的缓冲室),带来的不利后果是(填序号):B.
A、氢氧化钠与原料Na2HP03会发生反应 B、导致产品氢氧化钠中混有杂质,难以分离.

(3)三氯化磷(PC13)是一种重要的有机合成催化剂,实验室常用红磷与干燥的Cl2制取PC13,装置如图2所示.PCl3遇02会生成POCl3 (三氯氧磷),POCl3溶于PC13,PC13遇水会强烈水解生成亚磷酸和HCl,PCl3、POCl3的熔沸点见如表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PC13 | -112 | 75.5 |
| POCI3 | 2 | 105.3 |
①E烧杯内冷水的作用是冷凝PCl3蒸汽,便于PCl3收集.
②干燥管F的作用是收尾气中氯气,以免污染空气,防止空气中的水蒸气进入烧瓶使PCl3水解.
③检査装置气密性后,向D装置的曲颈瓶中加人红磷,打开K3通人干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通人氯气,反应立即进行,其中通人干燥CO2的目的是排尽曲颈瓶中的空气,防止PC13与O3等发生副反应.
(4)实验制得的粗产品中常含有POC13、PC15等,加入红磷加热除去PC15后,再通过蒸馏(填实验名称)即可得到较纯净的PC13.
3.对下列事实的解释错误的是( )
| A. | 浓硝酸在光照下颜色变黄,说明浓硝酸的不稳定性 | |
| B. | 常温下,铝制品可盛放浓硝酸,说明浓硝酸与铝不反应 | |
| C. | 蓝色石蕊试纸上滴入浓硝酸,试纸先变红再变白,说明浓硝酸有酸性和氧化性 | |
| D. | 二氧化氮受热后颜色变深,说明二氧化氮与四氧化氮共存 |
20.“类推”的思维方式在化学学习与研究中经常采用,但有时会产生错误结论.下列类推结论中,正确的是
( )
( )
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 | |
| C. | 由Na2O中阴阳离子个数比为1:2,可推出Na2O2中阴阳离子个数比为 1:1 | |
| D. | 由“2Fe+3Br2=2FeBr3”反应可推出“2Fe+3I2=2FeI3”反应也能发生 |
7.在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性.已知某有机物结构如下: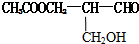 具有光学活性,当它发生下列反应后生成的有机物仍然一定具有光学活性的是( )
具有光学活性,当它发生下列反应后生成的有机物仍然一定具有光学活性的是( )
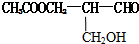 具有光学活性,当它发生下列反应后生成的有机物仍然一定具有光学活性的是( )
具有光学活性,当它发生下列反应后生成的有机物仍然一定具有光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与NaOH溶液共热 | ||
| C. | 与氧气发生催化氧化 | D. | 在催化剂存在下与H2作用 |
17.下列有关叙述中不正确的是( )
| A. | 第 VIIA族元素是同周期中非金属性最强的元素 | |
| B. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| C. | 元素周期表中从ⅠA到ⅡB之间12个纵列的元素都是金属元素 | |
| D. | 同周期元素中,ⅠA族元素的原子半径最大(稀有气体除外) |
4. 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )
①能与溴水发生取代反应
②1mol该物质最多能与4mol H2加成
③能使酸性KMnO4溶液褪色
④1mol该物质最多能与含2mol NaOH的溶液反应.
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍型如图所示,下列有关叙述正确的是( )①能与溴水发生取代反应
②1mol该物质最多能与4mol H2加成
③能使酸性KMnO4溶液褪色
④1mol该物质最多能与含2mol NaOH的溶液反应.
| A. | ①②③ | B. | ①③④ | C. | ③④ | D. | ②③④ |
1.按等物质的量混合的下列气体,碳元素的质量分数最大的是( )
| A. | 甲烷和乙烷 | B. | 乙炔和丙烯 | C. | 乙烷和乙烯 | D. | 丁炔和乙烯 |