题目内容
铜的冶炼大致可分为:①富集,将硫化物矿进行浮选;②焙烧,主要反应为2CuFeS2+4O2===Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1200 ℃发生的主要反应为2Cu2S+3O2===2Cu2O+2SO2,2Cu2O+Cu2S===6Cu+SO2↑;④电解精炼铜。下列说法不正确的是 ( )
| A.上述灼烧过程的尾气回收后可用来制硫酸 |
| B.上述过程中,由6 mol CuFeS2制取6 mol Cu时共消耗15 mol O2 |
| C.在反应2Cu2O+Cu2S===6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6 |
| D.在反应2Cu2O+Cu2S===6Cu+SO2↑中,只有Cu2O作氧化剂 |
D
试题分析:A.上述灼烧过程的尾气SO2可以使之催化氧化得到SO3,然后吸收利用可以制取硫酸。制取;B.根据上述反应过程的方程式可知:由6 mol CuFeS2制取6 mol Cu时共消耗15 mol O2,正确;C.在反应2Cu2O+Cu2S===6Cu+SO2↑中,氧化产物是SO2,还原产物是Cu,它们的物质的量的比1:6,正确。D.在反应2Cu2O+Cu2S===6Cu+SO2↑中, Cu2O和Cu2S都作氧化剂,错误。

练习册系列答案
相关题目

 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( ) =11,则溶液中
=11,则溶液中 =
=
 amol
amol amol
amol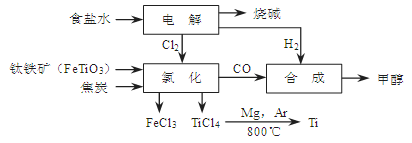
 CH3OH(g)。
CH3OH(g)。