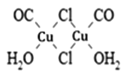
题目内容
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( )

A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56g Fe参加反应,共有NA个![]() 被还原
被还原
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为1×10-10mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
【答案】C
【解析】
A.设1 mol过硫酸钠(Na2S2O8)过氧键的数目为amol,其中S的化合价为+6价,则有2×(+1)+2×(+6)+(-2)a+(-2)×(8-2a)=0,解得a=1,所以1 mol过硫酸钠(Na2S2O8)含NA个过氧键,故A错误;
B.根据图示可知Fe最终变成氢氧化铁和氢氧化亚铁,无法确定转移电子数,故无法确定被还原的![]() 的量,故B错误;
的量,故B错误;
C. Fe(OH)3溶于水所得饱和溶液中存在平衡:![]() ,设c(Fe3+)=amol/L,则c(OH-)=3amol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=a×(3a)3=2.7×10-39,解得a=1×10-10mol/L,故C正确;
,设c(Fe3+)=amol/L,则c(OH-)=3amol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=a×(3a)3=2.7×10-39,解得a=1×10-10mol/L,故C正确;
D.pH越小,酸性越强,会使反应![]() 和
和![]() 平衡右移,无法生成沉淀越不利于去除废水中的正五价砷。
平衡右移,无法生成沉淀越不利于去除废水中的正五价砷。

【题目】50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液在图 1 装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)写出该反应的中和热热化学方程式:___________。
(2)___________(填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒,其原因是_____。
(3)如果改用 60mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(“增加”、“减少”或“不变”),所求中和热数值_____(“增加”、“减少”或“不变”)。
(4)某研究小组将装置完善后,把 V1 mL 1.0mol/L HCl 溶液和 V2 mL 未知浓度的 NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图 2 所示(实验中始终保持 V1+V2 = 50mL)。回答下列问题:研究小组做该实验时环境温度_________(填“高于”、“低于”或“等于”)22℃。
(5)①请填写下表中的空白:
温度 实验次数 | 起始温度 t1℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 32.9 | ________________________ |
2 | 27.0 | 27.4 | 27.2 | 37.0 | |
3 | 25.9 | 25.9 | 25.9 | 32.5 | |
4 | 26.4 | 26.2 | 26.3 | 33.3 | |
②近似认为 50mL 1.0molL-1 盐酸跟 50mL 1.1molL-1 氢氧化钠溶液的密度都是 1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃)。则中和热Δ H=_________( 取小数点后一位)。
【题目】1,![]() 二氯丙烷
二氯丙烷![]() 是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为
是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为![]() 氯丙烯
氯丙烯![]() ,反应原理为:
,反应原理为:
Ⅰ![]()
![]() CH2ClCHClCH3(g) H1= -134KJ/mol-1
CH2ClCHClCH3(g) H1= -134KJ/mol-1
Ⅱ![]()
![]() CH2=CHCH2Cl(g)+HCl(g) H2= -102KJ/mol-1
CH2=CHCH2Cl(g)+HCl(g) H2= -102KJ/mol-1
请回答下列问题:
![]() 已知
已知![]()
![]()
![]() 的活化能
的活化能![]() 正
正![]() 为132KJ/mol-1,则该反应的活化能
为132KJ/mol-1,则该反应的活化能![]() 逆
逆![]() 为__________ KJ/mol-1。
为__________ KJ/mol-1。
![]() 一定温度下,向恒容密闭容器中充入等物质的量的
一定温度下,向恒容密闭容器中充入等物质的量的![]() 和
和![]() ,在催化剂作用下发生反应Ⅰ、Ⅱ,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应Ⅰ、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间 | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强 | 80 |
|
|
|
|
|
|
①若用单位时间内气体分压的变化来表示反应速率,即ν=![]() ,则前
,则前![]() 内平均反应速率ν(CH2ClCHClCH3)=__________kPamin-1(保留小数点后2位
内平均反应速率ν(CH2ClCHClCH3)=__________kPamin-1(保留小数点后2位![]() 。
。
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率α=__________;反应Ⅰ的平衡常数
,则丙烯的平衡总转化率α=__________;反应Ⅰ的平衡常数![]() ________
________![]() 为以分压表示的平衡常数,保留小数点后2位
为以分压表示的平衡常数,保留小数点后2位![]() 。
。
![]() 某研究小组向密闭容器中充入一定量的
某研究小组向密闭容器中充入一定量的![]() 和
和![]() ,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得
,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得![]() 的产率与温度的关系如图所示。
的产率与温度的关系如图所示。

下列说法错误的是____________![]() 填代号
填代号![]() 。
。
![]() 使用催化剂A的最佳温度约为250℃
使用催化剂A的最佳温度约为250℃
![]() 相同条件下,改变压强会影响
相同条件下,改变压强会影响![]() 的产率
的产率
c.![]() 点是对应温度下
点是对应温度下![]() 的平衡产率
的平衡产率
![]() 提高
提高![]() 反应选择性的关键因素是控制温度
反应选择性的关键因素是控制温度
(4)在四个恒容密闭容器中充入相应量的气体(如图):

发生反应2N2O(g)![]() 2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:
2N2(g)+O2(g) △H,容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:

容器II、Ⅳ的体积为1L,容器Ⅳ中的物质也在470℃下进行反应,起始反应速率:
①![]() 正(N2O)____逆(N2O)。(填“>”“<”或“=”)
正(N2O)____逆(N2O)。(填“>”“<”或“=”)
②图中A、B、C三点处容器内密度最大的点是____(填“A”“B”或“C”)。