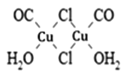
��Ŀ����
����Ŀ�����ҹ��Ϸ������ı�ѩ�ֺ��У�ʹ����һ����ѩ��������Ҫ�ɷֵĻ�ѧʽΪXY2��X��YΪ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ����1molXY2����54mol���ӡ�
(1)����ѩ���Ļ�ѧʽ______________��X����Ԫ���γɵĻ�����ĵ���ʽ_____________��
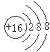
(2)Ԫ��D��Eԭ�ӵ�������������Ϊ���Ӳ�����2����D��Y���ڣ���D���ӵ�ԭ�ӽṹʾ��ͼ��____________ ��D��E���γ�һ�ַǼ��Է��ӣ��÷��ӵĽṹʽ____________��д�����以Ϊ�ȵ������һ�ַ��Ӻ�������________________��___________________��
(3)Ԫ��W��Yͬ���ڣ��䵥����ԭ�Ӿ��壻Ԫ��Z�ĵ��ʷ���Z2����3�����ۼ���W��Z���γ�һ���������ǽ������ϣ��仯ѧʽ��____________��
(4)Ԫ��R��Yͬ���壬���⻯�������ڿ�ʴ������д���÷�Ӧ�Ļ�ѧ����ʽ___________��
���𰸡�CaCl2 ![]()
 S=C=S CO2����N2O��BeCl2��
S=C=S CO2����N2O��BeCl2�� ![]() Si3N4 SiO2+4HF=SiF4��+2H2O
Si3N4 SiO2+4HF=SiF4��+2H2O
��������
X��YΪ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ����1molXY2����54mol���ӣ���ÿ����������18�����ӣ�����+2�ۡ�Y��-1�ۣ���XΪCa��YΪCl��XY2Ϊ�Ȼ��ơ�
(1)����ѩ���Ļ�ѧʽΪCaCl2��X����Ԫ���γɵĻ�����Ϊ�⻯�ƣ���Ϊ���ӻ�����������ʽΪ![]() ��
��
(2)Ԫ��D��Eԭ�ӵ�������������Ϊ���Ӳ�����2����������Ӳ�ṹ����Ϊ2��4�ṹ��2��8��6�ṹ��D��Y���ڣ���DΪSԪ�أ������ӵ�ԭ�ӽṹʾ��ͼ�� ��EΪCԪ�أ�D��E���γɵķǼ��Է�����CS2���÷��ӵĽṹʽΪS=C=S����������3��ԭ�ӡ�16���۵��ӣ������以Ϊ�ȵ������һ�ַ�����CO2������N2O��BeCl2�������以Ϊ�ȵ������������
��EΪCԪ�أ�D��E���γɵķǼ��Է�����CS2���÷��ӵĽṹʽΪS=C=S����������3��ԭ�ӡ�16���۵��ӣ������以Ϊ�ȵ������һ�ַ�����CO2������N2O��BeCl2�������以Ϊ�ȵ������������![]() ��
��
(3)Ԫ��W��Yͬ���ڣ��䵥����ԭ�Ӿ��壬��WΪSiԪ�أ�Ԫ��Z�ĵ��ʷ���Z2����3�����ۼ�����ZΪNԪ�ء�Si��N���γ�һ���������ǽ������ϣ�����N�ķǽ�����ǿ��Si���ڸû������У�Si��+4��N��-3�ۣ����仯ѧʽ��Si3N4��
(4)Ԫ��R��Yͬ���壬���⻯�������ڿ�ʴ��������RΪFԪ�أ��������Ը�ʴ�������÷�Ӧ�Ļ�ѧ����ʽSiO2+4HF=SiF4��+H2O��

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�����Ŀ��ijʵ���ҷ�Һ��![]() ��Na+��Fe3+��Cr3+��
��Na+��Fe3+��Cr3+��![]() ��
��![]() �����ӣ���ͨ���������̱��Ϊ���Ʊ�K2Cr2O7��
�����ӣ���ͨ���������̱��Ϊ���Ʊ�K2Cr2O7��

��֪��
(a)![]() ��
��![]()
(b)����������������������pH�������
�������� | pH | |
��ʼ���� | ��ȫ���� | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
��ش�
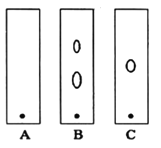
(1)ijͬѧ����ֽ�������жϲ���ټ���KOH�����Ƿ���ʡ��ڼ���һ����KOH��Һ����ëϸ��ȡ��������������ɫ��չ������Ѭ��İߵ���ͼ��ʾ������KOH���ʺϵ�ʵ������(ʵ��˳���Ѵ���)________��C�İߵ���ɫΪ________��
(2)����ں�Cr���ʷ�������Ҫ��Ӧ�����ӷ���ʽΪ________________________��
(3)������װ���У���Ӧѡ��________��(����)
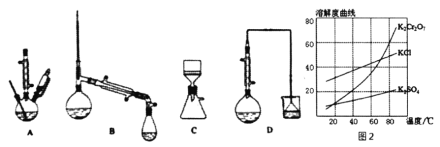
(4)�������ʵ��ܽ��������ͼ2������ݿ����õ����в��ֲ�����a�����������ִ������壬ֹͣ���ȣ�b����ȴ�����£�c����������Һ���־�Ĥ��ֹͣ���ȣ�d��ϴ�ӣ�e�����ȹ��ˣ�f�����ˡ���ѡ����ʲ�������ȷ˳��________��
(5)������к��ʵ�ϴ�Ӽ���________(����ˮ�Ҵ��������Ҵ�-ˮ���Һ��������ˮ��������ˮ��)��
(6)ȡmg�ֲ�Ʒ���250mL��Һ��ȡ25.00mL����ƿ�У���cmol��L-1��(NH4)2Fe(SO4)2����Һ�ζ�(���ʲ���Ӧ)�����ı�(NH4)2Fe(SO4)2��ҺVmL����ôֲ�Ʒ��K2Cr2O7�Ĵ���Ϊ________��
����Ŀ��1,![]() ���ȱ���
���ȱ���![]() ��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ��ñ�ϩ�ӳɷ��Ʊ�����Ҫ������Ϊ
��һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ��ñ�ϩ�ӳɷ��Ʊ�����Ҫ������Ϊ![]() �ȱ�ϩ
�ȱ�ϩ![]() ����Ӧԭ��Ϊ��
����Ӧԭ��Ϊ��
��![]()
![]() CH2ClCHClCH3(g) H1= -134KJ/mol-1
CH2ClCHClCH3(g) H1= -134KJ/mol-1
��![]()
![]() CH2=CHCH2Cl(g)+HCl(g) H2= -102KJ/mol-1
CH2=CHCH2Cl(g)+HCl(g) H2= -102KJ/mol-1
��ش��������⣺
![]() ��֪
��֪![]()
![]()
![]() �Ļ��
�Ļ��![]() ��
��![]() Ϊ132KJ/mol-1����÷�Ӧ�Ļ��
Ϊ132KJ/mol-1����÷�Ӧ�Ļ��![]() ��
��![]() Ϊ__________ KJ/mol-1��
Ϊ__________ KJ/mol-1��
![]() һ���¶��£�������ܱ������г�������ʵ�����
һ���¶��£�������ܱ������г�������ʵ�����![]() ��
��![]() ���ڴ��������·�����Ӧ�������������ѹǿ��ʱ��ı仯���±���ʾ��
���ڴ��������·�����Ӧ�������������ѹǿ��ʱ��ı仯���±���ʾ��
ʱ�� | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
ѹǿ | 80 |
|
|
|
|
|
|
�����õ�λʱ���������ѹ�ı仯����ʾ��Ӧ���ʣ�����=![]() ����ǰ
����ǰ![]() ��ƽ����Ӧ������(CH2ClCHClCH3)=__________kPamin-1(����С�����2λ
��ƽ����Ӧ������(CH2ClCHClCH3)=__________kPamin-1(����С�����2λ![]() ��
��
�ڸ��¶��£���ƽ��ʱHCl���������Ϊ![]() �����ϩ��ƽ����ת������=__________����Ӧ���ƽ�ⳣ��
�����ϩ��ƽ����ת������=__________����Ӧ���ƽ�ⳣ��![]() ________
________![]() Ϊ�Է�ѹ��ʾ��ƽ�ⳣ��������С�����2λ
Ϊ�Է�ѹ��ʾ��ƽ�ⳣ��������С�����2λ![]() ��
��
![]() ij�о�С�����ܱ������г���һ������
ij�о�С�����ܱ������г���һ������![]() ��
��![]() ���ֱ���A��B���ֲ�ͬ���������·�����Ӧ��һ��ʱ�����
���ֱ���A��B���ֲ�ͬ���������·�����Ӧ��һ��ʱ�����![]() �IJ������¶ȵĹ�ϵ��ͼ��ʾ��
�IJ������¶ȵĹ�ϵ��ͼ��ʾ��

����˵���������____________![]() �����
�����![]() ��
��
![]() ʹ�ô���A������¶�ԼΪ250��
ʹ�ô���A������¶�ԼΪ250��
![]() ��ͬ�����£��ı�ѹǿ��Ӱ��
��ͬ�����£��ı�ѹǿ��Ӱ��![]() �IJ���
�IJ���
c.![]() ���Ƕ�Ӧ�¶���
���Ƕ�Ӧ�¶���![]() ��ƽ�����
��ƽ�����
![]() ���
���![]() ��Ӧѡ���ԵĹؼ������ǿ����¶�
��Ӧѡ���ԵĹؼ������ǿ����¶�
(4)���ĸ������ܱ������г�����Ӧ��������(��ͼ)��

������Ӧ2N2O(g)![]() 2N2(g)+O2(g) ��H����������N2O��ƽ��ת������ͼ��ʾ��
2N2(g)+O2(g) ��H����������N2O��ƽ��ת������ͼ��ʾ��

����II���������Ϊ1L���������е�����Ҳ��470���½��з�Ӧ����ʼ��Ӧ���ʣ�
��![]() ��(N2O)____��(N2O)��(�������������=��)
��(N2O)____��(N2O)��(�������������=��)
��ͼ��A��B��C���㴦�������ܶ����ĵ���____(�A����B����C��)��