题目内容
20.下列反应的离子方程式中,不正确的是( )| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3+Ca2++OH-=CaCO3↓+H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO+H20+CO2=CaCO3↓+2HClO | |
| C. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:Ba2++2OH+2H++SO42-=BaSO4↓+2H2O | |
| D. | 碳酸氢钙溶液中加入盐酸:HCO3+H+=CO2↑+H20 |
分析 A.氢氧化钙少量,反应后碳酸根离子有剩余;
B.二氧化碳过量,反应生成碳酸氢钙和次氯酸;
C.溶液为中性时,硫酸氢钠与氢氧化钡的物质的量之比为2:1;
D.二者反应实质为碳酸氢根离子与氢离子反应生成二氧化碳气体和水.
解答 解:A.碳酸氢钠溶液中加入少量石灰水,离子方程式按照氢氧化钙的组成书写,正确的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,故A错误;
B.次氯酸钙溶液中通入过量CO2,反应不会生成碳酸钙沉淀,正确的离子方程式为:ClO-+CO2+H2O=HCO3-+HC1O,故B错误;
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,氢离子与氢氧根离子的物质的量相等,反应的离子方程式为:Ba2++2OH+2H++SO42-=BaSO4↓+2H2O,故C正确;
D.碳酸氢钙溶液中加入盐酸,反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:HCO3+H+=CO2↑+H20,故D正确;
故选AB.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
18.已知常温常压下在1L的水中可溶解40L NO2,NO2能与NaOH溶液发生反应:2NaOH+2NO2═NaNO3+Na2NO2 +H2O.以下各种尾气吸收装置中,不适合吸收NO2气体的是( )
| A. | 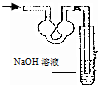 | B. | 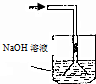 | C. | 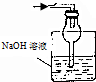 | D. | 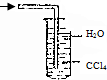 |
8.如表所示五种元素中,除M外其余均为短周期元素,Z和W的核外电子数之和是X核外电子数的5倍,下列说法$\underset{不}{•}$$\underset{正}{•}$$\underset{确}{•}$的是( )
| X | Y | |||
| Z | W | |||
| M |
| A. | M与Y可能形成M2Y3和M2Y5化合物 | |
| B. | 原子半径大小关系:Z>X>Y | |
| C. | 不能通过电解熔融Z、W组成的物质制备Z单质 | |
| D. | Y可以形成多种氢化物,其沸点均比X与H形成的化合物高 |
15.反应mA+nB?pC中,若v(A)=a mol•L-1•s-1,则v(C)为 (mol•L-1•s-1)( )
| A. | $\frac{pa}{m}$ | B. | $\frac{m}{pa}$ | C. | $\frac{ma}{p}$ | D. | $\frac{mp}{a}$ |
5.X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
| A. | 氢化物稳定性HmX>HnY | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质(X2)能将Y的阴离子(Y2-)氧化,并发生置换反应 | |
| D. | X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价 |
12.R、S、T三种物质分别为烷烃、炔烃、苯的同系物,若在一定条件下V L的R、S、T的混合气体恰好与V L的H2发生加成反应(体积为相同条件下测定),则混合气体中R、S、T的物质的量之比不可能是( )
| A. | 9:4:2 | B. | 11:5:3 | C. | 7:3:2 | D. | 3:1:1 |
9.某元素的原子最外层有2个电子,关于该元素的推断一定正确的是( )
| A. | 是金属元素 | B. | 是IIA族元素 | C. | 是非金属元素 | D. | 无法确定 |

 纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混合,是一种强氧化剂,水溶液俗称双氧水,为无色透明液体.其水溶液适用于医用伤口消毒及环境消毒和食品消毒.
纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混合,是一种强氧化剂,水溶液俗称双氧水,为无色透明液体.其水溶液适用于医用伤口消毒及环境消毒和食品消毒. .
.