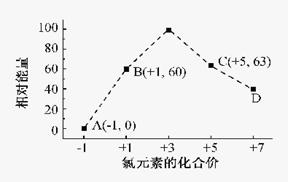
题目内容
氯气是一种重要的工业原料。工业上利用反应在3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气。下列说法正确的是
| A.若管道漏气遇氨就会产生白雾 | B.该反应利用了氨气的还原性 |
| C.该反应属于复分解反应 | D.生成6molNH4Cl有18mol电子转移 |
B
解析试题分析:氯气与氨气混合时发生氧化还原反应,生成白色的氯化铵固体小颗粒分散在空气中形成白烟,不可能产生白雾,因为液体小液滴分散在空气中才能形成白雾,故A项错误;氮元素由—3升为0价,发生氧化反应,则氨气是还原剂,显还原性,故B项错误;该反应前后氮、氯元素的化合价发生升降,而复分解反应中无元素化合价变化,故C项错误;根据元素化合价升降总数都是6,则3Cl2+8NH3=N2+6NH4Cl~6e-,该反应中氯化铵与转移电子的系数之比等于物质的量之比,生成6mol氯化铵时转移6mol电子,故D项错误。
考点:考查氧化还原反应,涉及氨气与氯化氢反应的现象、氧化剂和还原剂、氧化性和还原性、复分解反应、产物的物质的量与转移电子的物质的量之间的关系等。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案自来水常用Cl2消毒。某学生用这种自来水配制下列物质的溶液,不会产生明显的药品变质问题的是( )
| A.AgNO3 | B.NaCl | C.FeCl2 | D.Na2SO3 |
在Fe2(SO4)3、CuSO4、Al2(SO4)3的混合溶液中通入适量H2S,产生的沉淀物是
| A.FeS和CuS | B.CuS | C.CuS和S | D.Al2S3、FeS和CuS |
硝酸铜是制备Cu—Zn—Al系催化剂的重要原料。现有三种制取硝酸铜的实验方案可供选用:①铜与稀硝酸反应制取:3Cu + 8HNO3(稀)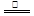 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O
②铜与浓硝酸反应制取:Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑+ 2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:2Cu + O2 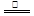 2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
| A.制取等量的硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
下列反应发生时,会产生棕黄色烟的是( )
| A.铁在氯气中燃烧 | B.铜在氯气中燃烧 |
| C.氢气在氯气中燃烧 | D.钠在氯气中燃烧 |
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
| n(SO32﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如图:
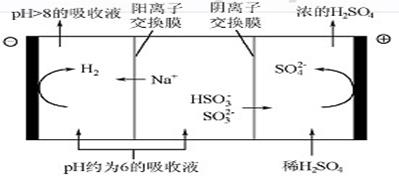
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,流程如下:
(Ⅰ)将含SO2的废气通入电解饱和食盐水后所得到的溶液中,得NaHSO3溶液。
(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。
(Ⅲ)将盐酸加入NaHSO3溶液中,反应所得到的SO2气体回收,生成的NaCl循环利用。
①写出步骤(Ⅰ)反应的化学方程式: 。
②写出步骤(Ⅱ)中电解饱和食盐水的化学方程式: 。
③写出步骤(Ⅲ)反应的离子方程式: 。
(2)还有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42-的转化率。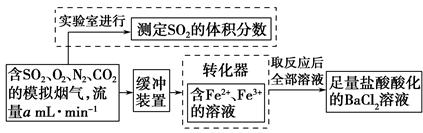
①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是 。(填写序号)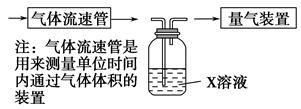
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
 的转化率,已知气体流速,还需测定的数据有 、 。
的转化率,已知气体流速,还需测定的数据有 、 。 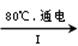 NaClO3溶液
NaClO3溶液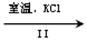 KClO3晶体
KClO3晶体