题目内容
硝酸铜是制备Cu—Zn—Al系催化剂的重要原料。现有三种制取硝酸铜的实验方案可供选用:①铜与稀硝酸反应制取:3Cu + 8HNO3(稀)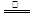 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O
②铜与浓硝酸反应制取:Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑+ 2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:2Cu + O2 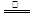 2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
| A.制取等量的硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
C
解析试题分析:A、根据制取硝酸铜的化学反应方程式可以判断:制备1molCu(NO3)2,需要HNO3的物质的量,①中需要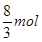 HNO3;②中需要4molHNO3;③中需要2molHNO3,所以需要硝酸的量②>①>③,③最少故A错误;B、由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1molCu(NO3)2,①中放出
HNO3;②中需要4molHNO3;③中需要2molHNO3,所以需要硝酸的量②>①>③,③最少故A错误;B、由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1molCu(NO3)2,①中放出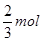 NO气体,②中放出2molNO2气体,③中没有气体放出,制取相同量的硝酸铜①产生的有毒气体比②少,故B错误;C、由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1molCu(NO3)2,①中需要
NO气体,②中放出2molNO2气体,③中没有气体放出,制取相同量的硝酸铜①产生的有毒气体比②少,故B错误;C、由制取硝酸铜三种设计方案的化学反应方程式可以判断:制备1molCu(NO3)2,①中需要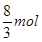 HNO3,放出
HNO3,放出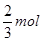 NO气体,硝酸利用率为
NO气体,硝酸利用率为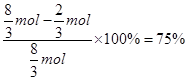 ;②中需要4molHNO3,放出 2molNO2气体,硝酸利用率为
;②中需要4molHNO3,放出 2molNO2气体,硝酸利用率为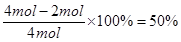 ;③中没有气体放出,HNO3的利用率为100%,三种方案中硝酸的利用率③>①>②,故C正确;D、稀硝酸与铁发生反应,且生成的 Cu(NO3)2 与铁反应,故不可以在铁制容器中进行,故D错误,答案选C。
;③中没有气体放出,HNO3的利用率为100%,三种方案中硝酸的利用率③>①>②,故C正确;D、稀硝酸与铁发生反应,且生成的 Cu(NO3)2 与铁反应,故不可以在铁制容器中进行,故D错误,答案选C。
考点:考查硝酸铜制备的有关判断、实验方案的涉及与评价、金属的性质等
点评:该题是中等难度的试题,也是高考中的常见题型,试题贴近高考,在注重对学生思维能力培养和训练的同时,还注重对学生环境保护意识和能源节约意识的培养,有利于培养学生的逻辑推理能力和发散思维能力。

 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案下列物质一般情况下不能用单质直接化合而制得的是( )
| A.HCl | B.NaCl | C.FeCl2 | D.CuCl2 |
漂粉精常用于消毒游泳池中的水。有关漂粉精的叙述不正确的是
| A.生产原料是消石灰和氯气 | B.不宜长久储存 |
| C.有腐蚀及漂白作用 | D.消毒后无残渣,不会堵塞管道 |
下列是有关物质的性质或用途的说法中正确的是
① 氯气具有漂白性,可以直接使有色布条褪色;② 二氧化硫具有较强的还原性,不能用浓硫酸干燥;③ SiO2是酸性氧化物,能与氢氟酸反应;④ Al(OH)3是两性氢氧化物,能溶于强酸或强碱。
| A.①②③ | B.②③④ | C.③④ | D.①②④ |
氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述正确的是
| A.“两水”都是混合物,溶液中含有的粒子种类、数目相同 |
| B.“两水”中都存在可逆反应的化学平衡和弱电解质的电离平衡 |
| C.“两水”都有刺激性气味,都能漂白有机色素 |
| D.“两水”放置时间较久后都会因为相同的原理而变质 |
氯气是一种重要的工业原料。工业上利用反应在3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气。下列说法正确的是
| A.若管道漏气遇氨就会产生白雾 | B.该反应利用了氨气的还原性 |
| C.该反应属于复分解反应 | D.生成6molNH4Cl有18mol电子转移 |
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
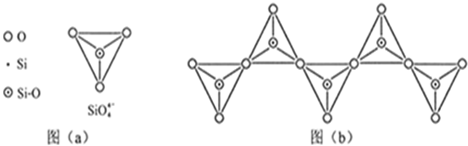
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为 。Si与O的原子数之比为 化学式为 。