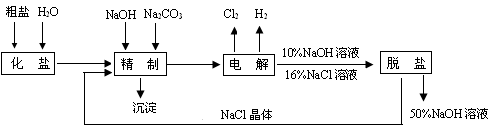
题目内容
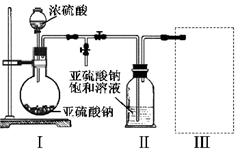
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
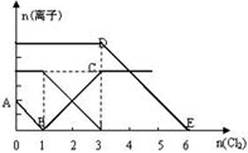
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
| n(SO32﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如图:
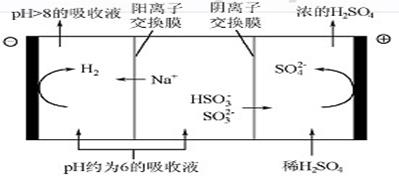
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
(1)SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 (4分) (2)SO2+2OH-=SO32-+H2O(2分)
(3)酸 ab(4分) (4)①HSO3—-2e-+H2O=3H++SO42- (3分)
②阴极室H+放电,OH-浓度增大,当pH>8时溶液NaOH浓度较大,可有效吸收SO2循环使用
解析试题分析:(1)二氧化硫溶于水生成亚硫酸,亚硫酸具有还原性,可与被氧化为硫酸,因此用化学方程式表示SO2形成硫酸型酸雨的反应为SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4。
(2)二氧化硫是酸性氧化物,因此NaOH溶液吸收SO2的离子方程式是SO2+2OH-=SO32-+H2O。
(3)当n(SO32﹣):n(HSO3﹣)=1:99时溶液显酸性,这说明HSO3﹣的电离常数大于HSO3﹣的水解程度,因此亚硫酸氢钠溶液显酸性。当n(SO32﹣):n(HSO3﹣)=1:1时溶液显碱性,因此要显中性,则亚硫酸氢钠的物质的量大于亚硫酸钠的物质的量,因此溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),b正确;根据电荷守恒可知c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),c(H+)=c(OH-),所以c(Na+)=2c(SO32-)+c(HSO3-),a正确,c不正确,答案选ab。
(4)①电解池中阳极失去电子,则HSO3-在阳极放电生成硫酸根,电极反应式是HSO3—-2e-+H2O=3H++SO42-。
②阴极是氢离子放电,则阴极室H+放电,OH-浓度增大,当pH>8时溶液NaOH浓度较大,可有效吸收SO2循环使用。
考点:考查硫酸型酸雨的形成、盐类水解和电离平衡的应用以及电解原理的应用

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列现象或事实能用同一原理解释的是
| A.浓硫酸、浓盐酸暴露在空气中浓度降低 |
| B.氯水、活性炭使红墨水褪色 |
| C.苯、四氯化碳加入溴水中,振荡、静置,水层颜色变浅 |
| D.漂白粉、亚硫酸钠长期暴露在空气中变质 |
氯气是一种重要的工业原料。工业上利用反应在3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气。下列说法正确的是
| A.若管道漏气遇氨就会产生白雾 | B.该反应利用了氨气的还原性 |
| C.该反应属于复分解反应 | D.生成6molNH4Cl有18mol电子转移 |