题目内容
自来水常用Cl2消毒。某学生用这种自来水配制下列物质的溶液,不会产生明显的药品变质问题的是( )
| A.AgNO3 | B.NaCl | C.FeCl2 | D.Na2SO3 |
B
解析试题分析:A、配制AgNO3溶液时,若用氯水,氯水中含有Cl-离子,则Ag+与Cl-反应生成AgCl沉淀,产生明显的药品变质问题,A错误;B、配制NaCl溶液时,溶液在的离子不会与氯水中的微粒发生反应,则不会产生明显的药品变质问题,D正确;C、配制FeCl2溶液时,若用氯水,氯水中含有Cl2、HClO、ClO-等微粒,具有氧化性,能氧化亚铁离子,则产生明显的药品变质问题,C错误;D、配制Na2SO3溶液时,氯水中含有H+,H+与亚硫酸根离子反应生成水和二氧化硫,则产生明显的药品变质问题,B错误;选 B .
考点:氯气的化学性质

练习册系列答案
相关题目
下列关于氯水的叙述正确的是
| A.新制氯水中只含Cl2和H2O分子 | B.光照氯水有气泡放出,该气体是Cl2 |
| C.氯水放置一段时间后颜色将变深 | D.新制氯水可使紫色石蕊试液先变红后褪色 |
漂白粉在空气中放置易失效的主要原因是( )
| A.Ca(ClO)2不稳定,易分解 | B.Ca(ClO)2易吸收水分而潮解 |
| C.Ca(ClO)2跟空气中的水和CO2反应 | D.Ca(ClO)2跟空气中的CO2反应 |
下列物质一般情况下不能用单质直接化合而制得的是( )
| A.HCl | B.NaCl | C.FeCl2 | D.CuCl2 |
已知某物质X能发生如下转化: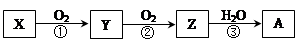
下列有关上述转化关系中物质及其反应的叙述错误的是
| A.若X为N2或NH3,则A为硝酸 |
| B.若X为S或H2S,则A为硫酸 |
| C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 |
14gCu、Ag合金与足量某浓度的硝酸反应,将放出的气体与1.12L O2(标况)混合,恰好能被水全部吸收生成硝酸,则合金中Cu的质量为
| A.1.6g | B.3.2g | C.6.4g | D.9.6g |
下列现象或事实能用同一原理解释的是
| A.浓硫酸、浓盐酸暴露在空气中浓度降低 |
| B.氯水、活性炭使红墨水褪色 |
| C.苯、四氯化碳加入溴水中,振荡、静置,水层颜色变浅 |
| D.漂白粉、亚硫酸钠长期暴露在空气中变质 |
氯气是一种重要的工业原料。工业上利用反应在3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气。下列说法正确的是
| A.若管道漏气遇氨就会产生白雾 | B.该反应利用了氨气的还原性 |
| C.该反应属于复分解反应 | D.生成6molNH4Cl有18mol电子转移 |