题目内容
9.下列变化规律正确的是( )| A. | 半径:Li>Na>K>Rb | |
| B. | 酸性:HClO4>H2SO4>H3PO4>H2CO3 | |
| C. | 气态氢化物的稳定性:HI>HBr>HCl>HF | |
| D. | 还原性:Cl->Br->I->S2- |
分析 A、同主族元素从上到下原子半径逐渐增大;
B、同主族元素从上到下,最高价含氧酸的酸性逐渐减弱,同周期从左到右最高价含氧酸的酸性逐渐增强;
C、同主族元素从上到下态氢化物的稳定性逐渐减弱;
D、主族元素从上到下离子的还原性逐渐增强.
解答 解:A、同主族元素从上到下原子半径逐渐增大,半径:Li<Na<K<Rb,故A错误
B、同主族元素从上到下,最高价含氧酸的酸性逐渐减弱,HClO4>H2SO4>H3PO4,H3PO4是中强酸,H2CO3是弱酸,所以H3PO4>H2CO3,酸性顺序是HClO4>H2SO4>H3PO4>H2CO3,故B正确;
C、同主族元素从上到下态氢化物的稳定性逐渐减弱,即稳定性顺序是:HI<HBr<HCl<HF,故C错误
D、主族元素从上到下离子的还原性逐渐增强,还原性顺序是:Cl-<Br-<I-<S2-,故D错误.
故选B.
点评 本题考查学生元素周期表中的递变规律以及应用等知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
19.在水溶液中能大量共存的一组离子是( )
| A. | K+、Na+、SO42-、Mn2+ | B. | Cl-、S2-、Fe2+、H+ | ||
| C. | Na+、Ba2+、Br-、CO32- | D. | Na+、H+、NO3-、HCO3- |
20.对下列图象的描述中,正确的
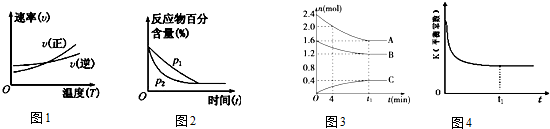 ( )
( )
 ( )
( )| A. | 根据图①可判断正反应的△H<0 | |
| B. | 图②可表示压强(p)对反应 2A(g)+2B(g)?3C(g)+D(s)的影响,P2 的压强大 | |
| C. | 图③可以表示的反应为 2A(g)+B(g)?C(g)△H<0 | |
| D. | 图④表示一定条件下,在绝热、恒容的密闭体系中进行的反应:NO(g)+NO2(g)?N2O3(g)△H<0,t1 时刻达到平衡状态 |
17.世界年产量95%以上的H2O2由蒽醌氧化法生产.反应过程如下:
①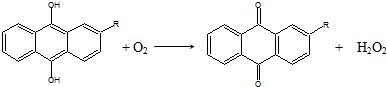
②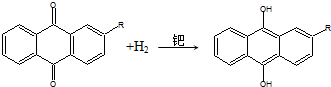
下列说法不正确的是( )
①

②
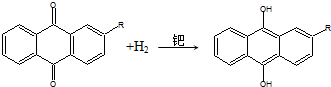
下列说法不正确的是( )
| A. | H2O2可用作漂白剂、消毒剂,也可作为火箭燃料 | |
| B. | H2O2可使湿润的KI淀粉试纸变蓝 | |
| C. | 蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2 | |
| D. | H2O2化学性质稳定,便于储存和运输 |
4.关于SO2的叙述中,正确的是( )
| A. | SO2的摩尔质量是64g | |
| B. | 1molSO2中所含分子数约为6.02×1023 | |
| C. | 1molSO2的质量是64g/mol | |
| D. | 常温常压下,1mol SO2的体积为22.4L |
14.某酸式盐NaHY的水溶液显碱性,下列叙述不正确的是( )
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY- 离子水解的离子方程式:HY-+H2O?H2Y+OH- | |
| C. | 该酸式盐溶液中离子浓度大小关系:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(H+)+c(H2Y)═c(OH-)+c(Y2-) |
 在100mL由HCl、AlCl3、MgCl2组成的混合溶液中,滴加5mol/L的NaOH溶液,产生白色沉淀的质量与加入NaOH溶液的体积之间的关系如图所示.
在100mL由HCl、AlCl3、MgCl2组成的混合溶液中,滴加5mol/L的NaOH溶液,产生白色沉淀的质量与加入NaOH溶液的体积之间的关系如图所示.