题目内容
(10分)一定的温度下向2L密闭容器中通入2molSO2和2molO2,发生反
应: 2SO2+O2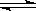 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1) 反应5min内,v(O2)=_________mol.L-1.min-1.
(2) 化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3) 判断该反应达到平衡的标志是_______________;
应: 2SO2+O2
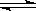 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.回答下列问题:
(1) 反应5min内,v(O2)=_________mol.L-1.min-1.
(2) 化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3) 判断该反应达到平衡的标志是_______________;
| A.v消耗(SO2)=v生成(SO3) | B.混合气体的平均相对分子质量不再改变 |
| C.混合气体的密度不再改变 | D.容器中气体的总物质的量不再变化 |
(1)0.08 (2)80%;0.6 mol.L-1; 0.8 (3)BD
(1)考查可逆反应的有关计算。
2SO2 + O2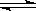 2SO3
2SO3
起始量(mol) 2 2 0
转化量(mol) 1.6 0.8 1.6
平衡量(mol) 0.4 1.2 1.6
所以氧气的反应速率是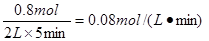
(2)SO2消耗的浓度占起始浓度的百分比为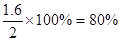
此时氧气的浓度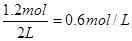
(3)A中反应速率方向相同,所以不能证明。混合气的密度是混合气的质量和容器容积的比值,质量和容积均不变,所以密度始终是不变的。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,质量不变,但混合气的物质的量是变化的,所以BD正确,即答案是BD。
2SO2 + O2
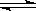 2SO3
2SO3起始量(mol) 2 2 0
转化量(mol) 1.6 0.8 1.6
平衡量(mol) 0.4 1.2 1.6
所以氧气的反应速率是
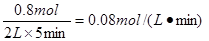
(2)SO2消耗的浓度占起始浓度的百分比为
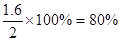
此时氧气的浓度
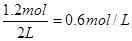
(3)A中反应速率方向相同,所以不能证明。混合气的密度是混合气的质量和容器容积的比值,质量和容积均不变,所以密度始终是不变的。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,质量不变,但混合气的物质的量是变化的,所以BD正确,即答案是BD。

练习册系列答案
相关题目

 2NO2 的平
2NO2 的平
 2NO(g) 能充分说明已达到平衡状态的是( )
2NO(g) 能充分说明已达到平衡状态的是( )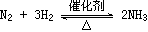 的说法错误的是( )
的说法错误的是( ) 2NH3(g)不能作为达到平衡状态的依据的是( )。
2NH3(g)不能作为达到平衡状态的依据的是( )。 Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )
Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )