题目内容
17.下列有关化学用语正确的是( )| A. | Cl-离子的结构示意图: | B. | 甲烷的结构式为: | ||
| C. | 丙烷分子的比例模型示意图: | D. | 乙醇的分子式:CH3CH2OH |
分析 A.氯离子的核电荷数为17、核外电子总数为18,最外层达到8电子稳定结构;
B.甲烷为正四面体结构,分子中存在4个碳氢键;
C. 为球棍模型,比例模型能够体现出各原子的相对体积大小;
为球棍模型,比例模型能够体现出各原子的相对体积大小;
D.CH3CH2OH为乙醇的结构简式,分子式中不需要标出官能团.
解答 解:A.氯离子的核电荷数为17,最外层为8个电子,Cl-正确的结构示意图为: ,故A错误;
,故A错误;
B.甲烷分子中含有4个碳氢键,为正四面体结构,甲烷的结构式为: ,故B正确;
,故B正确;
C.丙烷结构简式为CH3CH2CH3,丙烷的比例模型主要表示各原子的相对体积大小,丙烷正确的比例模型为: ,故C错误;
,故C错误;
D.乙醇的分子式为C2H6O,结构简式为C2H5OH或CH3CH2OH,故D错误;
故选B.
点评 本题考查了结构式、分子式、离子结构示意图、球棍模型表示方法判断,题目难度中等,注意掌握常见的化学用语的概念及正确表示方法,明确球棍模型与比例模型、分子式与结构简式的区别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A. | 第一电离能:Y可能大于或小于X | |
| B. | 气态氢化物的稳定性:HmY强于HnX | |
| C. | 最高价含氧酸的酸性X强于Y | |
| D. | X和Y形成化合物时,X显负价Y显正价 |
8.X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
| A. | 原子序数:X<Y | B. | 电负性:X<Y | C. | 离子半径:X>Y | D. | 原子半径:X<Y |
6.下列是反应2A+3B=C+4D在不同时刻测得的速率,其中最快的是( )
| A. | V(A)=0.6 mol/(L•s) | B. | V(B)=0.9 mol/(L•s) | C. | V(C)=0.4 mol/(L•s) | D. | V(D)=1.0 mol/(L•s) |
 .
. .
.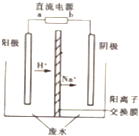 用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.
用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.