题目内容
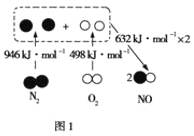
【题目】(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:P-P:198kJ·mol-1,P-O:360 kJ·mol-1,O=O:498kJ·mol-1,则反应P4(白磷)与O2反应生成P4O6的热化学反应方程式为____。

(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式_____。
(3)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。

【答案】P4(白磷,s)+3O2(g)=P4O6(g)△H= -1638kJ/mol 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H= -1048.9kJ/mol N2(g)+3H2(g)![]() 2NH3(I) △H=2(a-b-c)kJ/mol
2NH3(I) △H=2(a-b-c)kJ/mol
【解析】
(1)白磷燃烧生成P4O6的合成方程式为P4(白磷)+3O2= P4O6,根据白磷和P4O6的分子结构,结合放出的热量=生成物的键能-反应物的键能计算;
(2)根据盖斯定律分析计算△H;
(3)根据反应热等于反应物总能量减去生成物总能量,结合图示计算反应热,并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态。
(1)白磷燃烧生成P4O6的合成方程式为P4(白磷)+3O2= P4O6,根据白磷和P4O6的分子结构,放出的热量=生成物的键能-反应物的键能=12×360kJ-[(6×198)kJ+(3×498)kJ]=1638kJ,反应的焓变是-1638kJ/mol,则反应P4(白磷)燃烧生成P4O6的热化学方程式为:P4(白磷,s)+3O2(g)=P4O6(g)△H=-1638kJ/mol;故答案为:P4(白磷,s)+3O2(g)=P4O6(g) △H=-1638kJ/mol;
(2)肼和N2O4反应的化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),①N2(g)+2O2(g)═N2O4(l) △H1═ -19.5kJmol-1,②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1,根据盖斯定律,②×2-①得到2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=(-534.2kJmol-1)×2-(-19.5kJmol-1)=-1048.9kJ/mol,故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=-1048.9kJ/mol;
(3)根据反应热等于反应物总能量减去生成物总能量计算反应热。由图可以看出,![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H=(a-b)kJ/mol,而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,所以有
H2(g)=NH3(g) △H=(a-b)kJ/mol,而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,所以有![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) △H=(a-b-c)kJ/mol,故热化学方程式为N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1,故答案为:N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1。
H2(g)=NH3(l) △H=(a-b-c)kJ/mol,故热化学方程式为N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1,故答案为:N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
【题目】下列实验“操作和现象”与“结论”对应且正确的是( )
操作和现象 | 结论 | |
A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I |
C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.AB.BC.CD.D