题目内容
【题目】人体血液存在H2CO3/HCO3-、HPO42-/H2PO4-等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示c(H2CO3)/c(HCO3-)或c(HPO42-)/c(H2PO4-)]与pH的关系如图所示。已知碳酸pKal=6.4、磷酸pKa2=7.2(pKa= -lgKa)。则下列说法正确的是
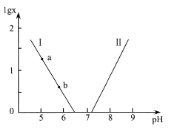
A. 曲线I表示lg c(HPO42-)/c(H2PO4-)与pH的变化关系
B. a-b的过程中,水的电离程度逐渐减小
C. 当c(H2CO3)=c(HCO3-)时,c(HPO42-)=c(H2PO4-)
D. 当pH增大时,c(HCO3-)c(H2PO4-)/c(HPO42-)逐渐减小
【答案】D
【解析】
H2CO3![]() HCO3-+H+的电离平衡常数Kal=c(H+)·c(HCO3-)/c(H2CO3),所以lgc(H2CO3)/c(HCO3-)=pKal-pH=6.4-pH,H2PO4-
HCO3-+H+的电离平衡常数Kal=c(H+)·c(HCO3-)/c(H2CO3),所以lgc(H2CO3)/c(HCO3-)=pKal-pH=6.4-pH,H2PO4-![]() HPO42-+H+的电离平衡常数Ka2=c(H+)·c(HPO42-)/c(H2PO4-),所以lgc(HPO42-)/c(H2PO4-)=pH-pKa2=pH-7.2,
HPO42-+H+的电离平衡常数Ka2=c(H+)·c(HPO42-)/c(H2PO4-),所以lgc(HPO42-)/c(H2PO4-)=pH-pKa2=pH-7.2,
A.当lgx=0时,pH分别为6.4、7.2;
B.酸对水的电离有抑制作用,酸性越强即pH越小,抑制作用越大,水的电离程度越小;
C.当c(H2CO3)=c(HCO3-)时,即lgc(H2CO3)/c(HCO3-)=0,溶液中pH=6.4,则lgc(HPO42-)/c(H2PO4-)=pH-7.2=6.4-7.2=-0.8;
D.c(HCO3-)·c(H2PO4-)/c(HPO42-)=c(HCO3-)·c(H+)/Ka2=Ka1×c(H2CO3)/Ka2,pH增大则H2CO3![]() HCO3-+H+正向进行,使c(H2CO3)减小。
HCO3-+H+正向进行,使c(H2CO3)减小。
A.当lgx=0时,pH分别为6.4、7.2,所以曲线I表示lgc(H2CO3)/c(HCO3-)=pKal-pH=6.4-pH,曲线II表示lgc(HPO42-)/c(H2PO4-)=pH-pKa2=pH-7.2,故A错误;
B.酸对水的电离有抑制作用,酸性越强即pH越小,抑制作用越大,水的电离程度越小,a-b的过程中pH增大,溶液酸性减弱,水的电离程度增大,故B错误;
C.当c(H2CO3)=c(HCO3-)时,即lgc(H2CO3)/c(HCO3-)=0,溶液中pH=6.4,则lgc(HPO42-)/c(H2PO4-)=pH-7.2=6.4-7.2=-0.8<0,即c(HPO42-)<c(H2PO4-),故C错误;
D、c(HCO3-)·c(H2PO4-)/c(HPO42-)=c(HCO3-)·c(H+)/Ka2=Ka1×c(H2CO3)/Ka2,pH增大则H2CO3![]() HCO3-+H+正向进行,使c(H2CO3)减小,Ka1、Ka2不变,所以pH增大时,c(HCO3-)c(H2PO4-)/c(HPO42-)逐渐减小,故D正确;
HCO3-+H+正向进行,使c(H2CO3)减小,Ka1、Ka2不变,所以pH增大时,c(HCO3-)c(H2PO4-)/c(HPO42-)逐渐减小,故D正确;
故选D。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案