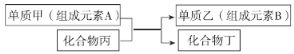
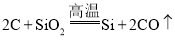题目内容
【题目】下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
【答案】C
【解析】
A.因为Ksp(AB2)=c(A2+)c2(B-),Ksp(CD)=c(C+)c(D-),Ksp(AB2)小于Ksp(CD),由于两者类型不同,AB2的溶解度不一定小于CD的溶解度,A错误;
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,减小了溶液中的Ag+、Cl-的浓度,溶解平衡正向移动,直至达到新的条件下的溶解平衡状态,由于温度不变,所以氯化银的Ksp不变,B错误;
C.在氯化银沉淀溶解平衡体系中,加入碘化钾固体,Ag+与加入的碘化钾电离产生的I-发生沉淀反应,生成溶解度比AgCl沉淀更小的AgI沉淀,破坏了AgCl的沉淀溶解平衡,AgCl继续溶解电离,产生的Ag+再与I-反应产生AgI沉淀,最终导致AgCl沉淀转化为碘化银沉淀,颜色由白色转化为黄色,C正确;
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,发生反应:![]() +2H+=CO2↑+H2O,破坏了CaCO3的沉淀溶解平衡,使它不断溶解,溶解产生的碳酸根离子继续与盐酸电离产生的H+发生反应,最终导致CaCO3完全溶解,D错误;
+2H+=CO2↑+H2O,破坏了CaCO3的沉淀溶解平衡,使它不断溶解,溶解产生的碳酸根离子继续与盐酸电离产生的H+发生反应,最终导致CaCO3完全溶解,D错误;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】菱锰矿的主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素。氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①相关金属离子[c0(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
②常温下,CaF2、MgF2的溶度积常数分别为1.46×10-10、 7.42×10-11
回答下列问题:
(1) “焙烧”时发生的主要反应的化学方程式为__________。气体X为________(填化学式),写出它生活中的一种用途_______________。
(2)焙烧时温度对锰浸出率的影响如图所示。焙烧时适应温度为_______________。

(3)浸出液“净化除杂”过程如下:首先用MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变成沉淀除去,溶液的pH的范围为____然后加入NH4F将Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,两种沉淀共存时,溶液中![]() =________(所得结果保留两位小数)。
=________(所得结果保留两位小数)。
(4)碳化结晶的原理(用离子方程式表示): ______________________。
(5)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为_________。
(6)在该工艺流程中可以循环使用的物质有__________。(填化学式)