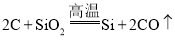题目内容
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
石墨转变为金刚石是吸热反应
B.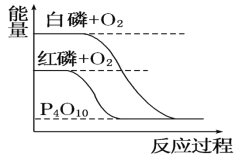 白磷比红磷稳定
白磷比红磷稳定
C.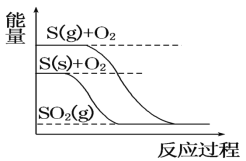 S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
D.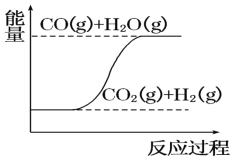 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
【答案】A
【解析】
A. 图象分析金刚石能量高于石墨,石墨转变为金刚石是吸热反应,故A正确;
B. 图象分析白磷能量高于红磷,能量越高越活泼,能量越低越稳定,白磷比红磷活泼,故B错误;
C. 依据图象分析固体硫变化为气态硫需要吸收能量,相同条件下,等质量S(g)和S(s)的能量比较,S(s)较小,△H1<△H2,故C错误;
D. 图象分析反应物CO(g)+H2O(g)的能量总和高于生成物CO2(g)+H2(g)的能量总和,反应是放热反应,故D错误;
故选:A。

【题目】“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:

己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
Ksp | 6×10-36 | 3×10-19 | ||||
pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
沉淀完全 | 6.7 | 9.2 | 3.2 | |||
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。
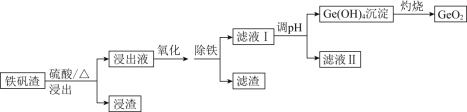
【题目】二氧化锗(GeO2)可用于制备半导体材料,某实验小组以铁矾渣(主要成分为FeO、CaO、GeO和SiO2等)为原料制取二氧化锗的工艺流程如下所示。
已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
离子 | Fe3+ | Mn2+ | Ge4+ |
开始沉淀时的pH | 2.3 | 8.3 | 8.2 |
沉淀完全时的pH | 4.1 | 9.8 | 11.2 |
请回答下列问题:
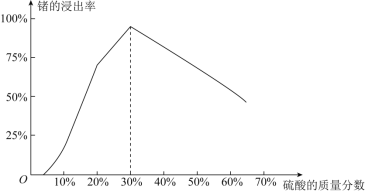
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为________,浸渣的主要成分为________________(填化学式)。
(2)“氧化”时,可选用的试剂为________(填字母)。
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为________________。“氧化”后,选用K3[Fe(CN)6]溶液证明Fe2+已全部被氧化的实验现象为________________________________________________。
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理为____________________________。
(5)已知Ge(OH)4,具有两性,在得到Ge(OH)4的过程中,若溶液的pH大于12,会导致Ge(OH)4溶解,写出该反应的离子方程式:________________________________。
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则阳极的电极反应式为___________________。