题目内容
【题目】实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=x
CO(g)+3H2(g) △H=x
已知:标准状态下,由最稳定的单质生成1mol化合物的焓变,称为该化合物的标准摩尔生成焓,几种物质的标准摩尔生成焓如下。则x=__kJ·mol-1。(标准摩尔生成焓:CH4(g)-75kJ/mol;H2O(g)-240kJ/mol;CO(g)-110kJ/mol;H2(g)-0kJ/mol)
(2)为了探究温度、压强对反应(1)的影响,在恒温恒容下,向下列三个容器中均充入4molCH4和4molH2O。
容器 | 温度/℃ | 体积/L | CH4平衡浓度/mol·L-1 | 平衡时间/min |
甲 | 400 | 1 | 1.5 | 5.0 |
乙 | 500 | 1 | x | t1 |
丙 | 400 | 2 | y | t2 |
①平衡前,容器甲中反应的平均速率![]() (H2)=__mol/(L·min);在一定条件下,能判断容器丙中的反应一定处于化学平衡状态的是__(填序号);
(H2)=__mol/(L·min);在一定条件下,能判断容器丙中的反应一定处于化学平衡状态的是__(填序号);
A.3v(CH4)正=v(H2)逆 B.CH4和H2O的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
②平衡后,乙容器中CH4的转换率较丙低,其原因是__,其中t1__t2(填“>”、 “<”或“=”)。
(3)pC是指极稀溶液中溶质物质的量浓度的负对数。已知常温下,H2CO3溶液中加入强酸或强碱后达到平衡时溶液中三种成分的pC-pH图,据图
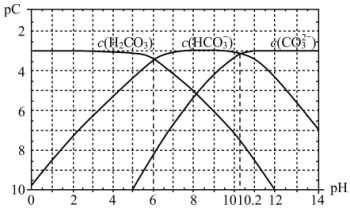
常温下,碳酸的一级电离常数Ka1的数量级为__;其中碳酸的Ka1>>Ka2,其原因是__。
(4)我国科学家根据反应CO2![]() C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和__;C2O52-在阳极发生电极反应,其方程式为__。
C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和__;C2O52-在阳极发生电极反应,其方程式为__。
【答案】+205 1.5 AC 根据勒夏特列原理,容器乙因温度比丙高,平衡正向移动,因压强比丙大平衡逆向移动,但压强影响为主,乙的转化率比丙低 < 1×10-6 碳酸不带电,而碳酸氢根带一个单位的负电荷 O2- 2C2O52-+4e- = O2↑+4 CO2↑
【解析】
⑴C(s) + 2H2 (g) = CH4 (g) △H=-75kJ/mol;
![]() O2(g) + H2 (g) = H2O(g) △H=-240kJ/mol;
O2(g) + H2 (g) = H2O(g) △H=-240kJ/mol;
C(s) + ![]() O2(g) = CO(g) △H=-110kJ/mol;
O2(g) = CO(g) △H=-110kJ/mol;
根据第3个方程减去第2 个和第1个方程得到CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H= + 205 kJ·mol-1。
CO(g)+3H2(g) △H= + 205 kJ·mol-1。
⑵①平衡前,容器甲中反应的平均速率甲烷开始的浓度为4 mol·L-1,平衡时的浓度为1.5 mol·L-1,改变的浓度为2.5 mol·L-1,则氢气的改变浓度为2.5mol·L-1×3=7.5 mol·L-1,则氢气的速率为![]() ;A选项,3v(CH4)正=v(H2)逆,一正一逆符合条件,速率比等于计量系数比,因此A符合;B选项,CH4和H2O的转化率相等,不能做为平衡的标志;C选项,该反应是体积增大的反应,当容器内压强保持不变,则达到平衡;D选项,密度等于质量除以体积,气体质量不变,容器体积不变,密度始终不变,因此混合气体的密度保持不变,不能作为判断平衡,因此AC正确。
;A选项,3v(CH4)正=v(H2)逆,一正一逆符合条件,速率比等于计量系数比,因此A符合;B选项,CH4和H2O的转化率相等,不能做为平衡的标志;C选项,该反应是体积增大的反应,当容器内压强保持不变,则达到平衡;D选项,密度等于质量除以体积,气体质量不变,容器体积不变,密度始终不变,因此混合气体的密度保持不变,不能作为判断平衡,因此AC正确。
②平衡后,根据勒夏特列原理,容器乙因温度比丙高,平衡正向移动,因压强比丙大平衡逆向移动,但压强影响为主,乙的转化率比丙低,由于乙容器温度高于丙,因此达到平衡所需时间短,即t1<t2。
⑶常温下,pH等于6时,碳酸浓度和碳酸氢根浓度相等,此时碳酸的一级电离常数Ka1的数量级为该点pH对应的氢离子浓度即1×10-6;其中碳酸的Ka1>>Ka2,其原因是碳酸不带电,易失去氢离子,而碳酸氢根带一个单位的负电荷,比较难失去氢离子。
⑷CO32-在阴极得到电子,C化合价降低得到碳单质和O2-;C2O52-在阳极O失去电子发生氧化反应生成氧气和二氧化碳,其方程式为2C2O52-+4e- = O2↑+4 CO2↑。
⑴C(s) + 2H2 (g) = CH4 (g) △H=-75kJ/mol;
![]() O2(g) + H2 (g) = H2O(g) △H=-240kJ/mol;
O2(g) + H2 (g) = H2O(g) △H=-240kJ/mol;
C(s) + ![]() O2(g) = CO(g) △H=-110kJ/mol;
O2(g) = CO(g) △H=-110kJ/mol;
根据第3个方程减去第2 个和第1个方程得到CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H= + 205 kJ·mol-1,故答案为:+205。
CO(g)+3H2(g) △H= + 205 kJ·mol-1,故答案为:+205。
⑵①平衡前,容器甲中反应的平均速率甲烷开始的浓度为4 mol·L-1,平衡时的浓度为1.5 mol·L-1,改变的浓度为2.5 mol·L-1,则氢气的改变浓度为2.5mol·L-1×3=7.5 mol·L-1,则氢气的速率为![]() ;A选项,3v(CH4)正=v(H2)逆,一正一逆符合条件,速率比等于计量系数比,因此A符合;B选项,CH4和H2O的转化率相等,不能做为平衡的标志;C选项,该反应是体积增大的反应,当容器内压强保持不变,则达到平衡;D选项,密度等于质量除以体积,气体质量不变,容器体积不变,密度始终不变,因此混合气体的密度保持不变,不能作为判断平衡,故答案为:1.5;AC。
;A选项,3v(CH4)正=v(H2)逆,一正一逆符合条件,速率比等于计量系数比,因此A符合;B选项,CH4和H2O的转化率相等,不能做为平衡的标志;C选项,该反应是体积增大的反应,当容器内压强保持不变,则达到平衡;D选项,密度等于质量除以体积,气体质量不变,容器体积不变,密度始终不变,因此混合气体的密度保持不变,不能作为判断平衡,故答案为:1.5;AC。
②平衡后,根据勒夏特列原理,容器乙因温度比丙高,平衡正向移动,因压强比丙大平衡逆向移动,但压强影响为主,乙的转化率比丙低,由于乙容器温度高于丙,因此达到平衡所需时间短,即t1<t2,故答案为:根据勒夏特列原理,容器乙因温度比丙高,平衡正向移动,因压强比丙大平衡逆向移动,但压强影响为主,乙的转化率比丙低;<。
⑶常温下,pH等于6时,碳酸浓度和碳酸氢根浓度相等,此时碳酸的一级电离常数Ka1的数量级为该点pH对应的氢离子浓度即1×10-6;其中碳酸的Ka1>>Ka2,其原因是碳酸不带电,易失去氢离子,而碳酸氢根带一个单位的负电荷,比较难失去氢离子,故答案为:1×10-6;碳酸不带电,而碳酸氢根带一个单位的负电荷。
⑷CO32-在阴极得到电子,C化合价降低得到碳单质和O2-;C2O52-在阳极O失去电子发生氧化反应生成氧气和二氧化碳,其方程式为2C2O52-+4e- = O2↑+4 CO2↑,故答案为:O2-;2C2O52-+4e- = O2↑+4 CO2↑。

 名校课堂系列答案
名校课堂系列答案【题目】“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:

己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
Ksp | 6×10-36 | 3×10-19 | ||||
pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
沉淀完全 | 6.7 | 9.2 | 3.2 | |||
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。
【题目】我国具有光辉灿烂的古代科技,早在商代就已经铸造出司母戊大方鼎。回答下列问题:
(1)Cu在元素周期表中的位置___,Cu2+的价电子排布式为__。
(2)已知基态铜的部分电离能如表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是__。
(3)Cu2+能与吡咯(![]() )的阴离子(
)的阴离子(![]() )形成双吡咯铜。
)形成双吡咯铜。
①![]() 中C和N原子的杂化均为__,1mol
中C和N原子的杂化均为__,1mol![]() 含有__molσ键;
含有__molσ键;
②双吡咯铜Cu(![]() )2的配位原子为__;
)2的配位原子为__;![]() 噻吩的沸点为84℃,吡咯(
噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,吡咯沸点较高,其原因是__。
)的沸点在129~131℃之间,吡咯沸点较高,其原因是__。
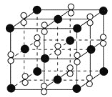
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表M原子)。每个铜原子周围距离最近的铜原子数目__;该晶体的化学式为__。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和M原子之间的最短距离为__pm(只写计算式)。