题目内容
10.有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:(提示:请注意氢谱中峰的高度比)| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)有机物A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使 其产物依次通过足量无水硫酸铜粉末、足量石灰水,发现硫酸铜粉末增重5.4g,石灰水中有30.0g白色沉淀生成. | (2)9.0g有机物A完全燃烧时,经计算: 生成CO2共为0.3mol, 生成的H2O0.3mol. 有机物A的分子式C3H6O3. |
| (3)经红外光谱测定,证实其中含有O-H键,-COOH基团,C-H键;经核磁共振氢谱的测定,其核磁共振氢谱图 如:  | (3)A的结构简式 . . |
| (4)如果经红外光谱测定,A的一种同分异构体中,存在O-H键, 还含有醛基,C-O键,  核磁共振氢谱的测定, 其核磁共振氢谱图如右: | (4)A的这种同分异构体的结构简式为: CH2(OH)CH(OH)CHO. |
| (5)如果经红外光谱测定,A的一种同分异构体中,存在O-H键,还含有C=O,C-O键, 核磁共振氢谱的测定, 其核磁共振氢谱图如:  | (5)A的这种同分异构体的结构简式为: . . |
分析 (1)根据密度与相对分子质量成正比计算;
(2)硫酸铜增重的质量为水的质量,白色沉淀为碳酸钙,碳酸钙的物质的量=二氧化碳的物质的量,分别根据n=$\frac{m}{M}$计算出水和二氧化碳的物质的量,再结合A的相对分子质量及质量守恒定律确定其分子式;
(3)根据A的分子式、经红外光谱测定结果及核磁共振氢谱中等效H的情况确定其含有的官能团及结构,然后写出其结构简式;
(4)根据红外光谱判断有机物含有的官能团,再结合其核磁共振氢谱判断其结构简式;
(5)先根据红外光谱判断有机物含有的官能团,再根据其核磁共振氢谱判断其结构简式.
解答 解:(1)同温同压下:密度比=相对分子质量之比,A的密度是相同条件下H2的45倍,故A的相对分子质量为45×2=90,故答案为:90;
(2)硫酸铜粉末增重的5.4g为水的质量,水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,故n(H)=0.3×2=0.6mol,m(H)=0.6×1=0.6g,
石灰水中有30.0g白色沉淀为碳酸钙,则碳酸钙的物质的量为:$\frac{30g}{100g/mol}$=0.3mol,根据C原子守恒,则二氧化碳的物质的量为0.3mol,m(C)=0.3×12=3.6g,故9.0gA中O的质量为:9.0-0.6-3.6=4.8g,则n(O)=$\frac{4.8g}{16g/mol}$=0.3mol,
故A分子中N(C):N(H):N(H)=0.3:0.6:0.3=1:2:1,A的最简式为CH2O,
由于A的相对分子质量为90,设A的分子式为(CH2O)n,则30n=90,解得:n=3,
故A的分子式为:C3H6O3,
故答案为:0.3;0.3;C3H6O3;
(3)经红外光谱测定,证实其中含有O-H键,-COOH基团,C-H键,说明该有机物分子中含有官能团为羧基和羟基,根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,则该有机物的结构简式为: ,
,
故答案为: ;
;
(4)如果经红外光谱测定,A的一种同分异构体中存在O-H键,还含有醛基、C-O键,结合其分子式C3H6O3可知,A的不饱和度为2,则该有机物分子中应该含有1个醛基、2个羟基;其核磁共振氢谱中H原子又5种,且H原子数之比为:2:1:1:1:1,则该有机物的结构简式为:CH2(OH)CH(OH)CHO,
故答案为:CH2(OH)CH(OH)CHO;
(5)如果经红外光谱测定,A的一种同分异构体中存在O-H键,还含有C=O,C-O键,说明该有机物分子中含有酯基或含有1个羰基、2个羟基;根据其核磁共振氢谱可知,其分子中含有2种H原子,原子数之比为:2:1,则该有机物分子中只能含有1个羰基、2个羟基,其结构简式为: ,
,
故答案为: .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用,明确核磁共振氢谱的含义为解答关键,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 乙烯与溴水(加成反应) | |
| B. | 甲苯与浓硝酸(硝化反应) | |
| C. | 氯乙烷与氢氧化钠醇溶液 (取代反应) | |
| D. | 乙烯与高锰酸钾(氧化反应) |
| A. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| B. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据是否含氧元素,将物质分为氧化剂和还原剂 | |
| D. | 根据水溶液或熔融状态是否能够导电,将化合物分为电解质和非电解质 |
| A. | CH4与C2H4 | |
| B. | CH3-CH=CH-CH3 与 CH3-CH2-CH2-CH3 | |
| C. | O2与O3 | |
| D. | C2H6与C3H8 |
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
| 浓度 时间(s) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热(t1℃) | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热(t2℃) | 360(a) | 480 | 540 | 720 |
| MnO2催化剂、加热(t2℃) | 10(b) | 25 | 60 | 120 |
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.

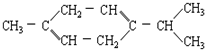 还可以简写为
还可以简写为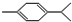 ,下列有机物中,与上述有机物互为同分异构体的是( )
,下列有机物中,与上述有机物互为同分异构体的是( )