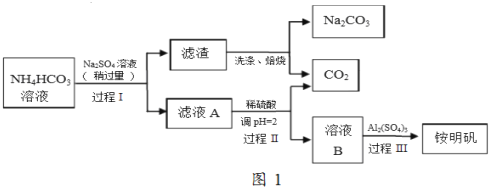
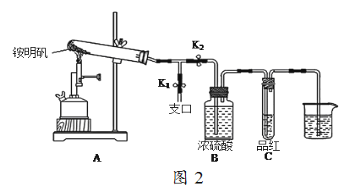
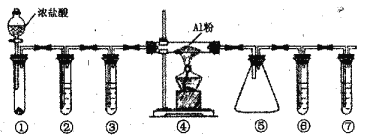
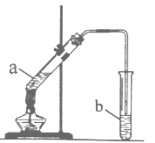
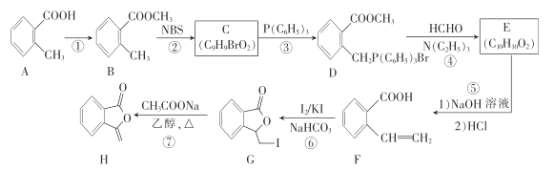
题目内容
【题目】下列离子方程式正确的是( )
A.氢氧化钡溶液与稀硫酸反应:Ba2++S![]() +H++OH-BaSO4↓+H2O
+H++OH-BaSO4↓+H2O
B.刻制印刷电路板的反应:Fe3++CuFe2++Cu2+
C.氯气与氢氧化钠溶液反应:Cl2+2OH-Cl-+ClO-+H2O
D.稀硫酸滴到铁片上:2Fe+6H+2Fe3++3H2↑
【答案】C
【解析】
A. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42+2H++2OHBaSO4↓+2H2O,故A错误;
B. 刻制印刷电路板的反应:2Fe3++Cu2Fe2++Cu2+,故B错误;
C. 氯气与氢氧化钠溶液反应:Cl2+2OHCl+ClO+H2O,故C正确;
D. 稀硫酸滴到铁片上: Fe+2H+Fe2++H2↑,故D错误。
综上所述,答案为C。

练习册系列答案
相关题目