题目内容
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
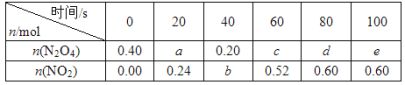
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
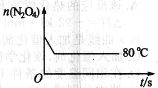
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
【答案】(1)0.002 0 (2)1.8 mol L1 (3)变浅
(4)D
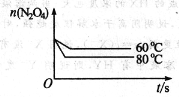
(5)如下图:
【解析】(1)20 s时,n(N2O4) =0.40 mol ![]() ×0.24 mol = 0.28 mol。
×0.24 mol = 0.28 mol。
v(N2O4)=![]() = 0.002 0 mol/(Ls)。
= 0.002 0 mol/(Ls)。
(2)反应进行到80 s时达到平衡状态,d = 0.40 mol![]() ×0.60 mol = 0.10 mol。
×0.60 mol = 0.10 mol。
K=![]() =
=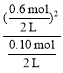 =1.8 molL1
=1.8 molL1
(3)降低温度,反应逆向进行,混合气体颜色变浅。
(4)K只是温度的函数,与反应物和生成物的浓度、催化剂无关。
(5)该反应为吸热反应,温度降低,平衡向逆反应方向移动,N2O4的平衡浓度增大,且到达平衡状态需要的时间更长,据此即可画出N2O4的变化曲线。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
