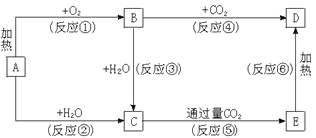
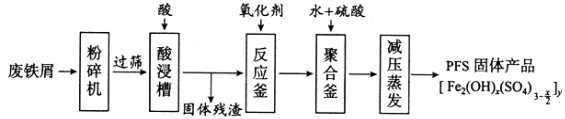
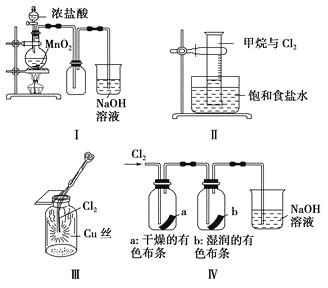
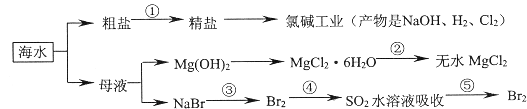
题目内容
【题目】有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
A.A﹥B﹥E﹥D B.D﹥A﹥B﹥E C.D﹥E﹥A﹥B D.A﹥B﹥D﹥E
【答案】B
【解析】
试题分析:原电池电子由负极流向正极,负极活泼,故活动性是A>B;当A、D组成原电池时,A为正极,故金属活动性为A<D ,B与E构成原电池时,B失去电子,即B做负极,金属活动性为B>E,故A、B、D、E金属性由强到弱的顺序为D>A>B>E,D正确,答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】某化学兴趣小组利用下图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题

(1)写出合成乙酸乙酯的化学方程式____________________________________。
(2)仪器b的名称________,图中起冷凝回流作用的是______(填a、b、c、d、e)。
(3)为了提高乙酸乙酯的产率可采取的措施 ___________________________________
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏
物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有________________杂质。