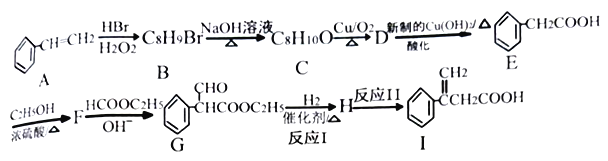
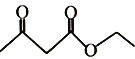
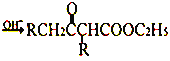题目内容
【题目】某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O_____
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.
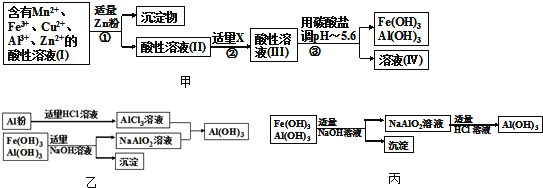
a、操作①中加Zn粉后发生反应的离子方程式为 ______ .
b、操作②中加入适量X的作用是什么 ______ ;X的首选物的化学式是: ______ .
c、操作③中所加碳酸盐的化学式是 ______ .
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为 ______ .若总共得到nmol Al(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 ______ 、 ______ .
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量? ______ .
【答案】3MnO2+ 2FeS +6 H2SO4 = 3MnSO4 + Fe2(SO4)3+2S+6H2O Zn+2Fe3+=Zn2++2Fe2+,Zn + Cu2+ =Zn2+ + Cu 将Fe2+氧化成Fe3+ MnO2 MnCO3或ZnCO3 Al3++3AlO2-+6H2O=4 Al(OH)3↓ ![]()
![]() 按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量均为nmol,大于乙流程的消耗量,相对而言,乙流程更符合节约的原则。
按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量均为nmol,大于乙流程的消耗量,相对而言,乙流程更符合节约的原则。
【解析】
⑴根据氧化还原反应配平方程式。
⑵加入锌,先是铁离子反应,再是铜离子反应,为了除掉铁元素,用氧化剂氧化亚铁离子变为铁离子,再通过调节溶液的pH值来除掉铁离子,一般用碳酸锰等。
⑶得到nmol氢氧化铝,根据化学方程式求出需要的铝离子和偏铝酸根离子的物质的量,再根据方程式计算需要消耗得盐酸和氢氧化钠的物质的量,分析乙、丙两种流程得到的相同的氢氧化铝消耗的盐酸和氢氧化钠的量来得出哪种方式更优。
⑴在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2中Mn的化合价降低2价,1molMnO2得到2mol电子,FeS中铁和硫的化合价都升高,1molFeS失去3mol电子,因此转移电子数为6,在FeS前面配系数2,MnO2配系数为3,再根据质量守恒配平其他物质的系数:3MnO2+ 2FeS +6H2SO4 = 3MnSO4 + Fe2(SO4)3+2S+6H2O,故答案为:3MnO2+ 2FeS +6H2SO4 = 3MnSO4 + Fe2(SO4)3+2S+6H2O。
⑵a、操作①中加Zn粉后发生反应的离子方程式为Zn+2Fe3+=Zn2++2Fe2+,Zn + Cu2+ =Zn2+ + Cu,故答案为:Zn+2Fe3+=Zn2++2Fe2+,Zn + Cu2+ =Zn2+ + Cu。
b、后面要将铁元素除掉,因此要先将亚铁离子氧化,操作②中加入适量X的作用是将Fe2+氧化成Fe3+,为了不引入新的杂质,因此X的首选物的化学式是:MnO2,故答案为:将Fe2+氧化成Fe3+,MnO2。
c、不引入新的杂质且要调节溶液的pH值,则操作③中所加碳酸盐的化学式是MnCO3或ZnCO3或MnCO3,故答案为:MnCO3或ZnCO33。
⑶a、流程乙中发生反应的离子方程式为:2Al+6H+=2Al3++3H2↑,Al(OH)3+OH-=AlO2-+2H2O,Al3++3AlO2-+6H2O=4 Al(OH)3↓,若总共得到n mol Al(OH)3,根据方程式,需要AlO2-的物质的量为![]() mol,则需要NaOH的物质的量为
mol,则需要NaOH的物质的量为![]() mol,Al3+的物质的量为
mol,Al3+的物质的量为![]() mol,消耗盐酸的物质的量为
mol,消耗盐酸的物质的量为![]() mol,因此消耗的NaOH和HCl的理论量(mol)分别为
mol,因此消耗的NaOH和HCl的理论量(mol)分别为![]() mol、
mol、![]() mol,故答案为:Al3++3AlO2-+6H2O=4 Al(OH)3↓;
mol,故答案为:Al3++3AlO2-+6H2O=4 Al(OH)3↓;![]() ;
;![]() 。
。
b、若使用如图丙流程回收处理,发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,AlO2-+H++H2O=Al(OH)3↓,生成n mol Al(OH)3,需要n mol盐酸和n mol偏铝酸根,生成n mol偏铝酸根需要n mol氢氧化铝和n mol氢氧化钠,因此按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量分别为nmol,大于乙流程的消耗量,相对而言,乙流程更符合节约的原则,故答案为:按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量分别为nmol,大于乙流程的消耗量,相对而言,乙流程更符合节约的原则。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ___ |
(2) | 乙炔 | ___ | ___ |
(3)D装置中氢氧化钠溶液的作用___。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯![]() 甲
甲![]() 乙
乙![]() PVC
PVC
(4)甲的结构简式是___;
(5)反应③的化学方程式是__。
(6)下列说法正确的是___。
A.乙烯可以作为植物生长调节剂
B.PVC不能使酸性高锰酸钾溶液褪色
C.PVC中的官能团是碳碳双键和氯原子
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
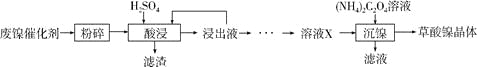
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是____________。
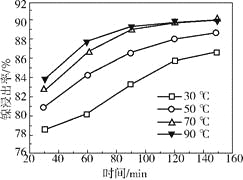
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。