题目内容
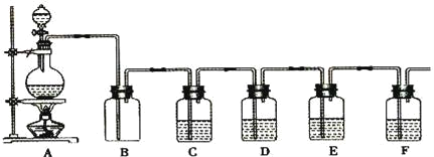
【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ___ |
(2) | 乙炔 | ___ | ___ |
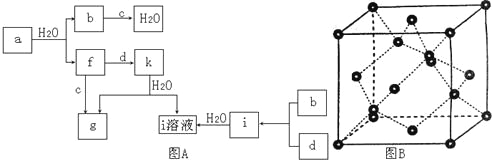
(3)D装置中氢氧化钠溶液的作用___。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯![]() 甲
甲![]() 乙
乙![]() PVC
PVC
(4)甲的结构简式是___;
(5)反应③的化学方程式是__。
(6)下列说法正确的是___。
A.乙烯可以作为植物生长调节剂
B.PVC不能使酸性高锰酸钾溶液褪色
C.PVC中的官能团是碳碳双键和氯原子
【答案】CH3CH2OH![]() CH2=CH2↑+H2O A→C→E CaC2+2H2O→CH≡CH↑+Ca(OH)2 除去二氧化碳和二氧化硫 CH2ClCH2Cl nCH2=CHCl
CH2=CH2↑+H2O A→C→E CaC2+2H2O→CH≡CH↑+Ca(OH)2 除去二氧化碳和二氧化硫 CH2ClCH2Cl nCH2=CHCl![]()
![]() AB
AB
【解析】
I.(1)实验室制取乙烯,需要加热到170℃,应该选择B装置,反应中会发生副反应生成二氧化硫,由于二氧化硫也可以使高锰酸钾溶液褪色,因此必须用氢氧化钠溶液除去,选择D装置除去二氧化硫,最后用高锰酸钾溶液检验乙烯的性质;
(2)常用电石(主要成分为CaC2)与水反应生成乙炔,固液不加热制气体,选A为反应装置,由于电石中常含有CaS等杂质,生成的乙炔中常含有H2S等杂质,需要用硫酸铜溶液除去,所以选C为除杂装置,选E为性质实验装置;
(3)NaOH溶液的作用为除杂;
II.CH2=CH2可与氯气发生加成反应生成CH2ClCH2Cl,CH2ClCH2Cl发生消去反应生成CH2=CHCl,CH2=CHCl发生加聚反应可生成PVC,据此解答即可。
Ⅰ.(1)实验室制取乙烯,需要加热到170℃,应该选择B装置,反应中会发生副反应生成二氧化硫,由于二氧化硫也可以使高锰酸钾溶液褪色,因此必须用氢氧化钠溶液除去,选择D装置除去二氧化硫、二氧化碳等,所以连接顺序为:B→D→E,实验室利用乙醇发生消去反应制乙烯的反应方程式为CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
故答案为:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(2)常用电石(主要成分为CaC2)与水反应生成乙炔,固液不加热制气体,选A为反应装置,由于电石中常含有CaS等杂质,生成的乙炔中常含有H2S等杂质,需要用硫酸铜溶液除去,所以选C为除杂装置,选E为性质实验装置,则装置的顺序为A→C→E,制备乙炔的反应方程式为CaC2+2H2O→CH≡CH↑+Ca(OH)2;
故答案为:A→C→E;CaC2+2H2O→CH≡CH↑+Ca(OH)2;
(3)由(1)可知,D装置中氢氧化钠溶液的作用是除二氧化碳和二氧化硫;
故答案为:除去二氧化碳和二氧化硫;
Ⅱ.CH2=CH2可与氯气发生加成反应生成CH2ClCH2Cl,CH2ClCH2Cl发生消去反应生成CH2=CHCl,CH2=CHCl发生加聚反应可生成PVC,
(4)CH2=CH2与氯气发生加成反应生成甲,甲的结构简式是CH2ClCH2Cl;
故答案为:CH2ClCH2Cl;
(5)反应③为CH2=CHCl发生加聚反应可生成PVC,反应的化学方程式是nCH2=CHCl![]()
![]() ;
;
故答案为:nCH2=CHCl![]()
![]() ;
;
(6)A. 乙烯可以作为植物生长调节剂,A项正确;
B. PVC没有碳碳双键,不能使酸性高锰酸钾溶液褪色,B项正确;
C. PVC没有碳碳双键,C项错误;
故答案为:AB;