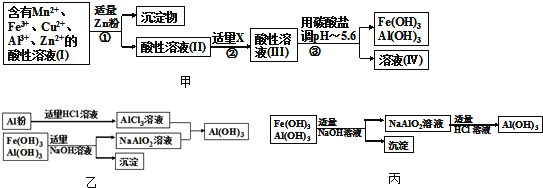
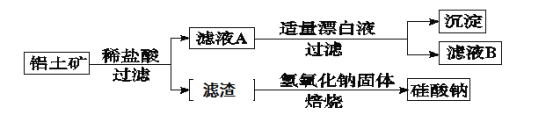
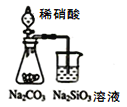
题目内容
【题目】下图是依据各种元素(原子)的性质与原子序数(1~20)的关系而绘制出来的,各图的纵轴可能代表下列某一性质:核电荷数,中子数、最高正化合价、原子半径、得电子能力,A、B、C分别代表三种元素.(注意:图3中原子序数为8、9的元素和图4中原子序数为2、10、18的元素在纵轴上没有对应的数值.)
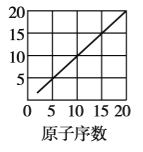
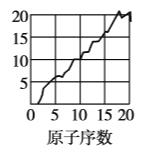
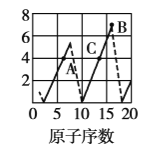
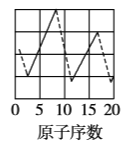
请回答下列问题:
(1)图2的纵轴代表的性质是______,图4的纵轴代表的性质是______.
(2)A元素的最低负化合价为______.
(3)B、C两种元素形成的化合物中,C显最高正化合价而B显最低负化合价,该化合物的化学式为______.
(4)1~20号元素中,原子(稀有气体元素原子除外)半径最大的是__(填元素符号)
(5)写出B的单质与NaOH溶液反应的离子方程式:____________________.
【答案】中子数 得电子能力 -4 SiCl4 K 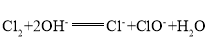
【解析】
根据题给图像分析可知:图1的纵轴表示核电荷数,图2的纵轴表示中子数,图3的纵轴表示最高正化合价,图4的纵轴表示得电子能力;图3中A、C的最高正化合价都是![]() ,所以A是碳,C是硅,B的最高正化合价是
,所以A是碳,C是硅,B的最高正化合价是![]() ,所以B是Cl。
,所以B是Cl。
(1)结合以上分析可知,图2的纵轴表示中子数,图4的纵轴表示得电子能力;
答案为:中子数; 得电子能力;
(2)A元素为碳,位于IVA族,最低负化合价为-4;
答案为:-4;
(3)Si与Cl形成共价化合物,化学式为![]() ;
;
答案为:![]() ;
;
(4)同周期元素原子(稀有气体元素原子除外)随着核电荷数的增大,原子半径逐渐减小,同主族元素原子随着核电荷数的增大,原子半径逐渐增大;
答案为:K;
(5)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,其离子方程式: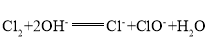 ;
;
答案为: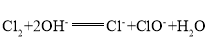 。
。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目