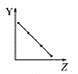题目内容
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
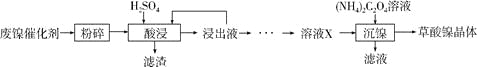
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是____________。
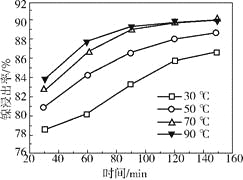
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。
【答案】增大接触面积,加快反应速率;提高镍的浸出率 C 静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成 洗去(NH4)2SO4杂质、便于烘干 防止温度过高,草酸镍晶体失去结晶水或分解 (加适量H2SO4溶液,)加足量H2O2溶液,充分反应后用NaOH溶液调节溶液5.0≤pH<6.7 用NaOH溶液调节“溶液X”的pH≥9.5 除去杂质Ca2+或CaSO4
【解析】
(1)粉碎的目的从速率和限度两个方面回答;
(2)由图中数据可知,从节约能源的角度分析,选择70℃,120min;
(3)继续加沉淀剂,若不再有沉淀生成,则说明已经沉淀完全;
(4)①从为什么要洗和为什么用乙醇洗两个方面考虑;
②温度过高,考虑挥发、分解、水解、氧化等影响;
(5)实验步骤第1步,利用Fe(OH)3和Al(OH)3的Ksp小的特点,先氧化Fe2+为Fe3+,然后调节溶液的PH,将铁、铝元素除去;第2步要除去Ca2+,利用NH4F溶液和Ca2+反应生成CaF2沉淀,充分反应后过滤,得“溶液X”;第3步使Ni2+成为Ni(OH)2沉淀,充分反应后过滤;第4步再把Ni(OH)2转化为NiSO4,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
(1)粉碎的目的是增大接触面积,使反应速率加快,同时提高镍的浸出率;
(2)由图中数据可知,当温度在70-90℃时,时间在120-150min时镍的浸出率最高,从节约能源的角度分析,应该选择70℃,120min,故选择c;
(3)要证明沉镍工序中Ni2+已经沉淀完全,只需将溶液静置,取上层清液,在上层清液中,滴加草酸铵溶液,观察有无沉淀生成,若无沉淀,说明已经沉淀完全;
(4)①用乙醇清洗的目的是洗去固体表面的(NH4)2SO4杂质,同时由于乙醇易挥发,便于烘干固体;
②烘干温度不超过110℃的原因是防止温度过高而使草酸镍晶体失水或者分解;
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,加入适量硫酸和过量的双氧水,使二价铁完全转化为三价铁,再用氢氧化钠溶液调节pH,使Al3+和Fe3+完全沉淀,充分反应后过滤,以除去铁、铝元素; 第2步:由于CaF2的Ksp较小,所以向所得滤液中加入适量NH4F溶液,和溶液中的F-生成CaF2沉淀以除去Ca2+,充分反应后过滤,得“溶液X”;第3步: 用NaOH溶液调节“溶液X”的pH,充分反应后过滤; 第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。其中第2步加入适量NH4F溶液的作用是除去Ca2+或者硫酸钙。

 优加精卷系列答案
优加精卷系列答案