题目内容
9. 2014 年10 月7 日,赤崎勇、天野浩和中村修二因发明“高亮度蓝色发光二极管(LED)”获得2014 年诺贝尔物理学奖.制作LED 首先在衬底上制作氮化镓(GaN)基的外延片,常用的衬底主要有蓝宝石(Al2O3)、碳化硅和硅,还有砷化镓(GaAs)、AlN、ZnO 等材料.回答下列问题:
2014 年10 月7 日,赤崎勇、天野浩和中村修二因发明“高亮度蓝色发光二极管(LED)”获得2014 年诺贝尔物理学奖.制作LED 首先在衬底上制作氮化镓(GaN)基的外延片,常用的衬底主要有蓝宝石(Al2O3)、碳化硅和硅,还有砷化镓(GaAs)、AlN、ZnO 等材料.回答下列问题:(1)氮和砷(As)位于同一主族,二者中电负性较大的是N(填元素符号,下同),第一电离能较大的是N.
(2)基态Zn 原子的价电子排布式为3d104s2,价层电子占有的原子轨道数为6
(3)Al2O3的熔点很高,Al2O3属于离子晶体.Al2O3的熔点比NaCl 高,其原因是Al2O3、NaCl都属于离子晶体,晶格能越大,离子晶体的熔点越高,Al2O3 晶体的晶格能大于NaCl 晶体的晶格能
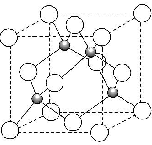
(4)碳化硅的晶胞结构如图所示,其中白球代表的是Si(或硅)原子,一个晶胞中含有该原子的个数为4.
分析 (1)同主族:从上到下,元素的电负性逐渐减小;同主族元素自上而下,随电子层增大,原子核等于最外层电子引力减弱,元素的第一电离能逐渐减小;
(2)锌是30号元素,基态原子核外有30个电子,其3d、4s能级上电子是其价电子,其价层电子占有的原子轨道数为6;
(3)Al2O3的熔点很高,熔融时能导电,属于离子化合物;结构相似的离子晶体,离子半径越小,晶格能越大,离子晶体的熔点越高;
(4)Si 的原子半径比C 大,故白球代表Si,黑球代表C;由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个.
解答 解:(1)N和As位于同一主族,且As排在N的下面,而同主族元素从上到下,电负性和第一电离能均逐渐减小,故电负性和第一电离能都是N 较大,
故答案为:N;N;
(2)锌是30号元素,基态原子核外有30个电子,核外电子排布为:[Ar]3d104s2,其3d、4s能级上电子是其价电子,所以Zn原子的价电子排布式为3d104s2,d能级有5个原子轨道,s能级有1个原子轨道,故Zn 的价层电子共占有6个原子轨道,
故答案为:3d104s2;6;
(3)Al2O3的是由氧离子和铝离子构成的化合物,其熔点很高,熔融时能导电,属于离子化合物,Al2O3、NaCl都属于离子晶体,晶体中Al3+、O2-的电荷数大于NaCl 晶体中Na+、Cl-的电荷数,且O2- 的半径小于Cl-的半径,Al2O3 晶体的晶格能大于NaCl 晶体的晶格能,晶格能越大,离子晶体的熔点越高,所以Al2O3的熔点比NaCl 高,
故答案为:离子;Al2O3、NaCl都属于离子晶体,晶格能越大,离子晶体的熔点越高,Al2O3 晶体的晶格能大于NaCl 晶体的晶格能;
(4)Si的原子半径比C大,故白球代表Si,黑球代表C,由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,晶胞中C为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子数为4,
故答案为:Si(或硅);4.
点评 本题考查较为综合,涉及电负性、第一电离能大小比较、核外电子排布规律、溶沸点大小比较、晶体结构等,注意影响离子晶体熔沸点高低的因素,把握晶体结构的判断方法,题目难度中等.

| A. | 决定反应速率的主要因素是反应物的浓度 | |
| B. | 化学反应速率为0.8 mol/(L•s) 是指1s 时某物质的浓度为0.8mol/L | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
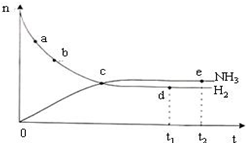
| D. | 如图表示密闭容器中673 K,30 MPa下的反应:N2(g)+3H2(g)?2NH3(g)△H<0,n(NH3)和n(H2)随时间变化的关系曲线图.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| A. | CO2+H2O═H2CO3 | B. | C+O2═CO2 | ||
| C. | CO2+2KOH═K2CO3+H2O | D. | CaO+CO2═CaCO3 |
| A. | 铁器 | B. | 石器 | C. | 青铜器 | D. | 合成材料 |
| A. | A2BC3 | B. | ABC3 | C. | ABC4 | D. | ABC |
| A. | 吸热反应 | B. | 放热反应 | ||
| C. | 反应的△H=0 | D. | 无法判断是吸热反应还是放热反应 |
| A. | 常温常压下,8 g O2含有4NA个电子 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
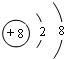 .
.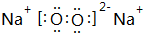 ,X的A2B2型化合物的结构式是H-O-O-H.
,X的A2B2型化合物的结构式是H-O-O-H.