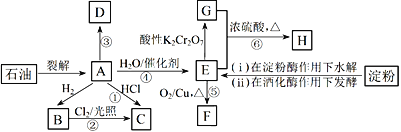
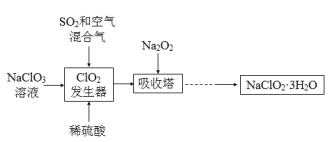
题目内容
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
【答案】B
【解析】
A.未达到平衡状态,气体的密度也一直不变;
B.该反应进行到第3分钟时向正反应方向进行;
C.根据v=△c/△t计算;
D.根据压强之比等于物质的量之比计算。
A.容器内气体密度不再发生变化,容器容积不变,气体的总质量不变,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故A错误;
B.根据表中数据可知反应进行到第3分钟时没有达到平衡状态,反应向正反应方向进行,则逆反应速率小于正反应速率,故B正确;
C.由表格数据可知,4min时达到平衡,消耗二氧化硫为0.20mol-0.08mol=0.12mol,即生成SO3为0.12mol,浓度是0.06mol/L,则用SO3表示的平均反应速率为0.06mol/L÷4min=0.015 mol/(Lmin),故C错误;
D.开始SO2和O2的物质的量分别为0.2mol、0.1mol,由表格数据可知平衡时SO2、O2、SO3的物质的量分别为0.08mol、0.04mol、0.12mol,由压强之比等于物质的量之比可知,达到平衡状态时的压强与起始时的压强之比为(0.08+0.04+0.12)/(0.2+0.1)=4:5,故D错误;
答案选B。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案