题目内容
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”;G能与NaHCO3溶液反应放出CO2气体。
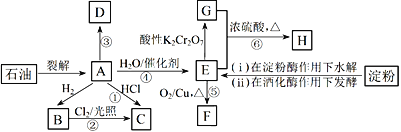
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。
反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
【答案】羟基 加聚反应 c CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ① 反应①为加成反应,无副反应发生,原子利用率高
2CH3CHO+2H2O ① 反应①为加成反应,无副反应发生,原子利用率高
【解析】
有机物A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯CH2=CH2,A与H2发生加成反应才的B是乙烷CH3CH3,乙烷与Cl2光照反应产生C,A与HCl也发生反应产生C,则C是氯乙烯CH3CH2Cl,A在一定条件下反应产生的D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”;则D是聚乙烯![]() ;乙烯与水发生加成反应产生的E是乙醇CH3CH2OH,乙醇催化氧化产生的F是乙醛CH3CHO;乙醇被酸性K2Cr2O7氧化产生的G是乙酸CH3COOH,乙醇与乙酸发生酯化反应产生的H是乙酸乙酯CH3COOCH2CH3,然后逐一分析解答。
;乙烯与水发生加成反应产生的E是乙醇CH3CH2OH,乙醇催化氧化产生的F是乙醛CH3CHO;乙醇被酸性K2Cr2O7氧化产生的G是乙酸CH3COOH,乙醇与乙酸发生酯化反应产生的H是乙酸乙酯CH3COOCH2CH3,然后逐一分析解答。
根据上述分析可知:A是CH2=CH2,B是CH3CH3,C是CH3CH2Cl,D是![]() ,E是CH3CH2OH,F是CH3CHO;G是CH3COOH, H是CH3COOCH2CH3。
,E是CH3CH2OH,F是CH3CHO;G是CH3COOH, H是CH3COOCH2CH3。
(1)E是CH3CH2OH,官能团是-OH,名称为羟基。反应③是乙烯在一定条件下发生加聚反应产生聚乙烯,乙醇该反应的反应类型加聚反应。
(2) a.B是乙烷,物质分子结构温度,不能被溴水或酸性高锰酸钾溶液氧化,因此不能使溴水或酸性高锰酸钾溶液褪色,聚乙烯分子中也没有不饱和的碳碳双键,也不能使溴水或酸性高锰酸钾溶液褪色,乙烯能与溴水发生加成反应,也能被酸性高锰酸钾溶液氧化,因此可是溶液褪色,a错误;
b.B是乙烷,在烷烃的同系物中,当碳原子数等于4时,可以有丁烷、异丁烷两种不同结构,所以是C≥4时就开始出现同分异构现象,b错误;
c.乙烯与聚乙烯最简式相同,所以等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等,c正确;
故合理选项是c;
(3)反应④是乙烯与水发生加成反应产生乙醇,方程式为:CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
反应⑤是乙醇催化氧化产生乙醛,反应的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(4)C是氯乙烷,该物质是由分子构成的分子晶体,分子间作用力很小,容易气化。当该物质由液态变为气态时,吸收大量的热,使周围环境温度降低,因此是一种速效局部冷冻麻醉剂,该物质可由反应①或②制备,由①乙烯与HCl发生加成反应产生时,原子利用率是100%,无副反应发生,而反应②除产生氯乙烷外还有HCl产生,会导致大气污染,所以相对来说①反应制备较好。

 小学生10分钟口算测试100分系列答案
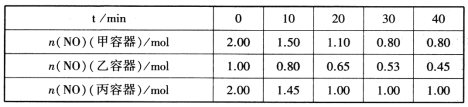
小学生10分钟口算测试100分系列答案【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4