题目内容
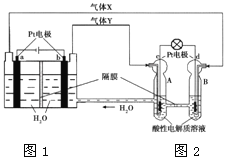
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化物法生产亚氯酸钠的工艺流程图:
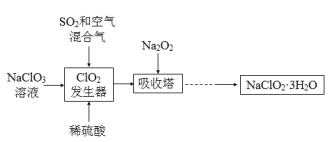
已知:
①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释至10%以下较安全;
(1)NaClO2中Cl的化合价为______。
(2)在发生器中鼓入SO2和空气混合气的原因是______ (填序号)。
A 空气稀释ClO2以防止爆炸
B SO2将NaClO3氧化成ClO2
C 稀硫酸可以增强NaClO3的氧化性
(3)Na2O2可改为H2O2和NaOH的混合溶液,吸收塔中发生的反应的化学方程式______;吸收塔的温度不能超过20oC,主要原因是______。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是______ (填序号)。
A 蒸馏 B 蒸发浓缩 C 灼烧 D 过滤 E 冷却结晶
【答案】+3 AC 2NaOH + 2ClO2 + H2O2=O2+2NaClO2 + 2H2O Na2O2产生的H2O2易分解 BED
【解析】
(1)NaClO2中Na元素的化合价为+1价,O元素的化合价为-2价,根据化合物的化合价代数和为0可知,Cl的化合价为+3价,故答案为:+3。
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,SO2被空气中的氧气氧化为SO3,SO3与水反应生成硫酸,硫酸可以增强NaClO3的氧化性,故选AC,故答案为AC。
(3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=O2+2NaClO2+2H2O;H2O2不稳定,温度过高,H2O2容易分解,化学方程式为2H2O2=2H2O+O2↑,故答案为:2NaOH+2ClO2+H2O2=O2+2NaClO2+2H2O,Na2O2产生的H2O2易分解。
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,所以操作顺序为BED,得到的粗晶体经过重结晶可得到纯度更高的晶体,故答案为:BED。

【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4