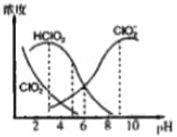
题目内容
【题目】下列叙述正确的是 ![]()
A.某二元酸![]() 在水中的电离方程式是:
在水中的电离方程式是:![]() ,
,![]() ;则NaHA溶液中:
;则NaHA溶液中:![]()
B.相同温度下将足量氯化银固体分别放入相同体积的①蒸馏水、②![]() 盐酸、③
盐酸、③![]() 氯化镁溶液、④
氯化镁溶液、④![]() 硝酸银溶液中,
硝酸银溶液中,![]() 为①>④=②>③
为①>④=②>③
C.常温下,某溶液的![]() ,则该物质一定是酸或强酸弱碱盐
,则该物质一定是酸或强酸弱碱盐
D.若![]() 、
、![]() 、
、![]() 分别表示常温下
分别表示常温下![]() 的电离平衡常数、
的电离平衡常数、![]() 的水解平衡常数和水的离子积常数,则三者之间的关系为
的水解平衡常数和水的离子积常数,则三者之间的关系为![]()
【答案】D
【解析】
A.由![]() 在水中的电离方程式知,
在水中的电离方程式知,![]() 只能电离,不能水解,所以由物料守恒知
只能电离,不能水解,所以由物料守恒知![]() ,选项A错误;
,选项A错误;
B.![]() 蒸馏水中含银离子浓度和氯离子浓度相等;
蒸馏水中含银离子浓度和氯离子浓度相等;![]() 溶液中,
溶液中,![]() ,抑制沉淀溶解平衡;
,抑制沉淀溶解平衡;![]() 溶液中
溶液中![]() 浓度为
浓度为![]() ,抑制沉淀溶解平衡;
,抑制沉淀溶解平衡;![]() 溶液中
溶液中![]() 浓度为
浓度为![]() ,抑制沉淀溶解平衡,
,抑制沉淀溶解平衡,![]() 浓度越大,
浓度越大,![]() 浓度越小,则
浓度越小,则![]() 浓度大小为:
浓度大小为:![]() ,选项B错误;
,选项B错误;
C.![]() 的溶液也可能为
的溶液也可能为![]() 强酸的酸式盐
强酸的酸式盐![]() ,选项C错误;
,选项C错误;
D.分别写出![]() 电离平衡常数表达式
电离平衡常数表达式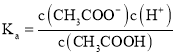 、
、![]() 的水解平衡常数表达式为
的水解平衡常数表达式为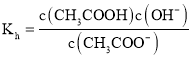 ,则
,则![]() ,选项D正确。
,选项D正确。
答案选D。

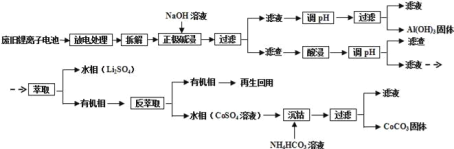
【题目】X、Y、Z、W为短周期元素,若W原子的最外层电子数是其内层电子的![]() ,如图所示,下列说法不正确的是
,如图所示,下列说法不正确的是
X | Y | |
Z | W |
A.X元素的氢化物分子间可以形成氢键
B.Y元素的两种同素异形体常温下都是气体
C.阴离子半径从大到小的顺序为X>Y>Z>W
D.最高价氧化物对应的水化物的酸性:W>Z
【题目】![]() 时,将
时,将![]() 的某一元酸HA与
的某一元酸HA与![]() 的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是
的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是![]()
微粒 |
|
|
|
浓度 |
|
|
|
A.所得溶液中:![]()
B.![]() 时,水的离子积
时,水的离子积![]()
C.![]() 时,一元酸HA的电离常数
时,一元酸HA的电离常数![]()
D.![]() 时,
时,![]() 溶液中
溶液中![]() 的水解率为
的水解率为![]()
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
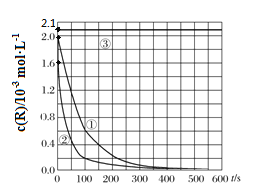
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液