题目内容
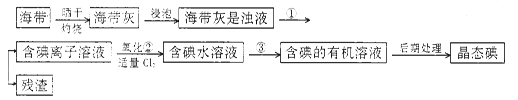
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:

请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是______________________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________、_______________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:_________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_____________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、______(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56a kg A(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36b kg A和1.12c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料__________ kg。
【答案】TiO2+2H2SO4===Ti(SO4)2+2H2O或TiO2+H2SO4===TiOSO4+H2O 2Fe3++Fe===3Fe2+Fe+2H+===H2↑+Fe2+Ti++ 4H2O![]() TiO2·H2O+4H+加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解H2O、FeSO4、H2SO41.60a+3.20b+1.60c
TiO2·H2O+4H+加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解H2O、FeSO4、H2SO41.60a+3.20b+1.60c
【解析】
(1)化学方程式为:TiO2+2H2SO4=Ti (SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O;
(2)浓硫酸有强氧化性,加入钛铁矿渣中能生成Fe3+,加入铁粉,发生Fe+2Fe3+=3Fe2+;铁粉还可以与溶液中过量的H+反应,离子方程式为:Fe+2H+=Fe2++H2↑;
(3) 钛盐水解的离子方程式:Ti++ 4H2O![]() TiO2
TiO2![]() H2O+4H+;
H2O+4H+;
(4)影响钛盐水解的因素有浓度、温度等,高温水蒸气使水解平衡移动的作用是:加水、加热、降低H+浓度均可促进钛盐水解;
(5)根据该工艺流程知:滤液Ⅲ的主要成分为大量的钛盐、溶解的硫酸亚铁、少量的硫酸(混合液pH达0.5)等,钛盐水解后过滤去水合二氧化钛,得到的滤液中含有未水解的钛盐及FeSO4、H2SO4、H2O等;
(6)依题意A与适量氢氧化钠溶液恰好完全反应,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,根据开始加入A为2a×103mol,可知加入氢氧化钠为4a×103mol;后来又加入12b×103mol的A和
20cmol的铁,由Na2SO4、FeSO4、Fe2(SO4)3、Fe2O3等化学式的定量组成和守恒思想分别可求得以下各量:利用Na+离子守恒,n(NaOH)=2n(Na2SO4),可知Na2SO4物质的量为20amol;利用SO42-离子守恒,n(FeSO4)=n(Na2SO4)+3n[Fe2(SO4)3],可知Fe2(SO4)3物质的量为(20a+120b-20a)mol×![]() =40bmol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2)mol×
=40bmol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2)mol×![]() =(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c) kg
=(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c) kg

【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)