��Ŀ����
����Ŀ��������һ����Ҫ�Ĺ�ҵԭ�ϣ�ij�о���ѧϰС��������ϵ�֪��Ư�������ᷴӦ����ȡ��������ѧ����ʽΪ��Ca��ClO��2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2��+2H2O���������ø÷�Ӧ�����ͼ��ʾװ����ȡ��������֤�����ʵ�ʵ�顣(B��װ����KI��Һ��C��װNa2SO3��Һ��D��װFeCl2��Һ)
2CaSO4+2Cl2��+2H2O���������ø÷�Ӧ�����ͼ��ʾװ����ȡ��������֤�����ʵ�ʵ�顣(B��װ����KI��Һ��C��װNa2SO3��Һ��D��װFeCl2��Һ)

�ش��������⣺
��1����ʵ����A���ֵ�װ����______�����ţ���

��2��װ��B�в���������Ϊ______��
��3�������ʵ����֤װ��C�е�Na2SO3�ѱ�����______��
��4��д��Dװ���з�����Ӧ�����ӷ���ʽ______��
��5����ʵ��������Ե�ȱ�ݣ���������Ľ��ķ���______��
���𰸡�b ����KI��Һ���� ȡ�����ȼ�HCl�ữ���ټ�BaCl2��Һ�����а�ɫ�������ɣ���ԭ������Na2SO3�ѱ����� 2Fe2++Cl2��2Fe3++2Cl- ʵ��ȱ��β������װ�ã�Ӧ��D������һ��ʢ��NaOH��Һ���ձ�
��������
�����������ķ�Ӧѡ����ʵ�ʵ��װ�ã��־�������ǿ�����Իش�������⡣
(1)Ư�������ᷴӦ������Ӧʹ�ù�Һ��������װ�ã�ѡbװ�ã�
(2)װ��B�з�����ӦCl2+2I-=2Cl-+I2�����ɵĵ������۱�����
(3)ͨ����ʱ��װ��C�з�����ӦCl2 +SO32��+H2O=2Cl-+2H++SO42���������ù����������ȥ����δ��Ӧ��SO32��������BaCl2��Һ�������ɵ�SO42�����ʷ�Ӧ��ȡC��������Һ����HCl�ữ���ټ�BaCl2��Һ�����а�ɫ�������ɣ���ԭ������Na2SO3�ѱ�������
(4)ʵ��ʱD����Һ�ӵ���ɫ����ػ�ɫ����ӦΪ2Fe2++Cl2��2Fe3++2Cl-��
(5)�������ж����壬�ŷŵ������л���Ⱦ������ʵ��װ��ĩ��ȱ��β������װ�ã�Ӧ��D������һ��ʢ��NaOH��Һ���ձ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����̽��������ˮ�ɷּ����ʵ�ʵ���У��������з������������ܵó���Ӧ���۵���
���� | ���� | ���� | |
A | �۲���ˮ��ɫ | ��ˮ�ʻ���ɫ | ��ˮ�к�Cl2 |
B | ��NaHCO3��Һ�м���������ˮ | ����ɫ������� | ��ˮ�к�HClO |
C | ���ɫֽ���ϵμ���ˮ | ��ɫֽ����ɫ | ��ˮ����Ư���� |
D | ��FeCl2��Һ�еμ���ˮ | ��Һ����ػ�ɫ | ��ˮ���������� |
A. A B. B C. C D. D
����Ŀ����Ԫ�ػ��ϼۺ�������������Ƕ��о����ʵ����ʣ���һ����֮��Ч�ķ�������������Ԫ��������ʵĶ�άͼ�IJ�����Ϣ��
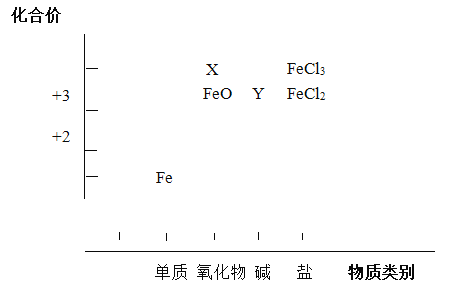
(1)�ֱ�д��X��Y�Ļ�ѧʽ______��______��
(2)д��FeO��ϡ���ᷴӦ�Ļ�ѧ����ʽ____________��
(3)FeCl2�Ⱦ���������Ҳ���л�ԭ�ԣ��ֱ�д�������������ԡ���ԭ�Եķ�Ӧ�����ӷ���ʽ��
| ���ӷ���ʽ |
������ | ____________________ (һ������) |
��ԭ�� | ____________________ (һ������) |
(4)ijͬѧԤ��Fe3+������S2-������Ӧ��Ϊ��֤Ԥ�⣬�����������Ϣ��ѡ���������Լ�����ʵ�飬ȷ���˷�Ӧ�ķ�����
���ϣ�����������ܽ��Ա�(����)
������ ������ | S2- |
Na+ | �� |
Fe3+ | �� |
Fe2+ | �� |
ѡȡ���Լ���______��______�����ܷ��������ֲ�ͬԭ���ķ�Ӧ�����ӷ���ʽ�ǣ�_________��__________��