题目内容
2.下列电离方程式错误的是( )| A. | NaHCO3=Na++H++CO32- | B. | NaOH=Na++OH- | ||
| C. | H2SO4=2H++SO42- | D. | KCl=K++Cl- |
分析 A.碳酸氢钠为强电解质,在溶液中电离出钠离子和碳酸氢根离子,碳酸氢根离子为多元弱酸碳酸的酸根离子,不能拆写;
B.氢氧化钠为强碱电离出钠离子和氢氧根离子;
C.硫酸为强酸,能完全电离出氢离子和硫酸根离子;
D.氯化钾为盐,属于强电解质,完全电离出钾离子和氯离子.
解答 解:A.碳酸氢根离子为多元弱酸碳酸的酸根离子,不能拆写,碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故A错误;
B.氢氧化钠为强碱完全电离:NaOH=Na++OH-,故B正确;
C.硫酸为二元强酸,能完全电离H2SO4=2H++SO42-,故C正确;
D.氯化钾为盐,属于强电解质,完全电离KCl=K++Cl-,故D正确;
故选A.
点评 本题考查了电离方程式的书写正误判别,侧重基础知识的考查,题目难度不大,注意掌握强弱电解质的概念,明确电离方程式的书写方法,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
5.质量相等的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为( )
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
2.下列指定微粒的个数比为2:1的是( )
| A. | Be2+中的质子和电子 | |
| B. | NaHCO3晶体中的阳离子和阴离子 | |
| C. | ${\;}_{1}^{2}$H原子中的中子和质子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
9.在体积相同的两个密闭容器中分别充入O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A. | 两种气体的压强相等 | B. | 两种气体的氧原子数目相等 | ||
| C. | 两种气体的分子数目相等 | D. | O2比O3的质量小 |
7.下图中,能表示灼热的炭与二氧化碳反应的能量变化的是( )
| A. | 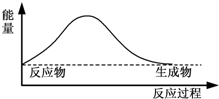 | B. | 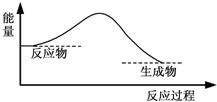 | ||
| C. | 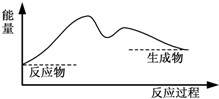 | D. | 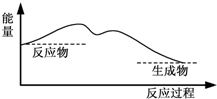 |
14.表示下列变化的化学用语正确的是( )
| A. | 明矾能净水:Al3++3H2O?Al(OH)3+3H+ | |
| B. | 醋酸溶液显酸性:CH3COOH=CH3COO-+H+ | |
| C. | NaHCO3溶液显碱性:HCO3-+H2O?CO32-+OH- | |
| D. | Fe(OH)3胶体的制备:Fe3++3H2O=Fe(OH)3↓+3H+ |
11.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 乙醇、乙酸均能与钠反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能 |
12.有乙醛蒸气与乙炔的混合气体aL,当其充分燃烧时,消耗相同状况下O2的体积为( )
| A. | 2aL | B. | 2.5aL | ||
| C. | 3aL | D. | 条件不足无法计算 |
 如图是实验室进行“喷泉”实验的一种装置,使用下列物质一定不会出现“喷泉”现象的是( )
如图是实验室进行“喷泉”实验的一种装置,使用下列物质一定不会出现“喷泉”现象的是( )