题目内容
5.质量相等的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为( )| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
分析 根据铝与足量的氢氧化钠溶液和稀盐酸反应的化学方程式可知,酸、碱足量时,铝完全反应,则铝的质量相等生成的氢气也相等.
解答 解:由2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,酸、碱均过量,则铝完全反应,铝的物质的量相等,从方程式中可以看到铝与氢气的比例都是2:3,因此产生的氢气是相等的,生成氢气的体积比为1:1,
故选A.
点评 本题主要考查了铝与酸、碱的反应,明确铝与氢氧化钠的反应方程式及Al的物质的量相同是解题关键,题目难度中等.

练习册系列答案
相关题目
15.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 单质的颜色依次加深 | B. | 氢化物的稳定性依次增强 | ||
| C. | 单质的氧化性依次减弱 | D. | 离子的还原性依次增强 |
16.下列各组中两种微粒的半径(用r表示)之比小于1的是( )
| A. | $\frac{r(Na)}{r(N{a}^{+})}$ | B. | $\frac{r(S)}{r({S}^{2-})}$ | C. | $\frac{r(Mg)}{r(Al)}$ | D. | $\frac{r(Cl)}{r(F)}$ |
13.下列做法,不能使CaCO3+2HCl═CaCl2+CO2↑+H2O的反应速率增大的是( )
| A. | 增大盐酸的浓度 | B. | 碾碎碳酸钙 | ||
| C. | 适当加热 | D. | 把盐酸换成同浓度硫酸 |
17.下列各组物质中互为同位素的是( )
| A. | ${\;}_{20}^{40}$Ca和${\;}_{18}^{40}$Ar | B. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | ||
| C. | H2O和H2O2 | D. | O3和O2 |
2.下列电离方程式错误的是( )
| A. | NaHCO3=Na++H++CO32- | B. | NaOH=Na++OH- | ||
| C. | H2SO4=2H++SO42- | D. | KCl=K++Cl- |
3.下列化合物中不能由单质直接化合而成的是( )
| A. | Fe3O4 | B. | HF | C. | FeCl2 | D. | CuCl2 |
 .
.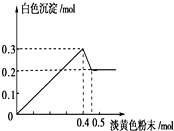 有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如图所示.
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如图所示.