题目内容
4.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 0.5 L1mol/L NaHS溶液中,N(Na+)+N(HS-)=NA | |
| B. | 12.4g白磷(分子式为P4)中含有P-P共价键0.6NA | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA | |
| D. | 将92gN2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA |
分析 A.根据物料守恒判断,溶液中还存在硫化氢分子和硫离子;
B.白磷分子式为P4,是正四面体型结构,分子中含有6个P-P共价键;
C.强酸溶液体积,无法计算溶液中氢离子数目;
D.恢复到常温常压时,部分四氧化二氮转化成二氧化氮,气体分子数增大.
解答 解:A.0.5 L1mol/L NaHS溶液中含有溶质硫氢化钠0.5mol,根据物料守恒可得:N(Na+)+N(H2S)+N(S2-)+N(HS-)=NA,故A错误;
B.12.4 g白磷(分子式为P4)的物质的量是:$\frac{12.4g}{124g/mol}$=0.1mol,白磷分子中含有6个P-P共价键,则0.1mol白磷分子中含有0.6molP-P共价键,含有P-P共价键0.6 NA,故B正确;
C.没有告诉该醋酸溶液的体积,无法计算溶液中氢离子的数目,故C错误;
D.92g四氧化二氮的物质的量为:$\frac{92g}{92g/mol}$=1mol,N2O4在容器中存在平衡:N2O4?2NO2,所以将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体的物质的量大于1mol,气体分子数大于NA个,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B为易错点,注意明确白磷分子的组成及结构.

练习册系列答案
相关题目
15.在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
回答下列问题:(1)该反应化学平衡常数的表达式:K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
(2)该反应为吸热(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是B
A、容器中压强不变 B、混合气体中c(CO)不变
C、混合气体的密度不变 D、c(CO)=c(CO2)
E、化学平衡常数K不变 F、单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应为吸热(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是B
A、容器中压强不变 B、混合气体中c(CO)不变
C、混合气体的密度不变 D、c(CO)=c(CO2)
E、化学平衡常数K不变 F、单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
9.对于某些离子的检验及结论一定正确的是( )
| A. | 通入Cl2后,溶液变为黄色,加淀粉液后溶液变蓝,则原溶液中一定有I- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- | |
| C. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
13.下列说法正确的是( )
| A. | 3p3表示3p能级有三个轨道 | |
| B. | 基态碳原子的价电子排布图: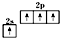 | |
| C. | 冰和固体碘晶体中相互作用力不完全相同 | |
| D. | 某气态团簇分子结构如图所示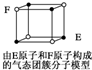 ,该气态团簇分子的分子式为EF或FE ,该气态团簇分子的分子式为EF或FE |
 CH3COOCH2CH3+H2O,该反应的类型为取代反应.
CH3COOCH2CH3+H2O,该反应的类型为取代反应.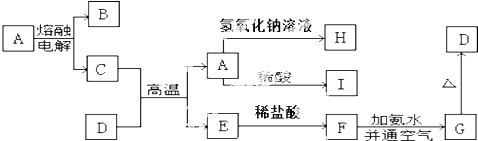
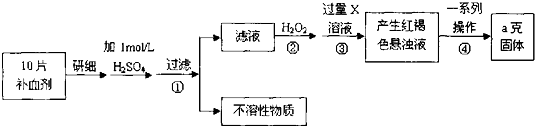
 .
.