题目内容
9.对于某些离子的检验及结论一定正确的是( )| A. | 通入Cl2后,溶液变为黄色,加淀粉液后溶液变蓝,则原溶液中一定有I- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- | |
| C. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
分析 A.能使淀粉变蓝的物质为碘单质;
B.不能排出生成AgCl;
C.可能含有HCO3-;
D.沉淀可能为碳酸钙.
解答 解:A.加淀粉液后溶液变蓝,说明生成碘,则溶液中一定含有电离子,故A正确;
B.不能排出生成AgCl,应先加入盐酸,如无现象,再加入氯化钡检验是否含有SO42-,故B错误;
C.可能含有HCO3-,可在原溶液种加入氯化钡进一步检验,故C错误;
D.沉淀可能为碳酸钙,不一定含有钡离子,故D错误.
故选A.
点评 本题考查了离子检验的方法应用,反应现象判断,关键是干扰离子的分析判断,掌握常见离子的检验方法和反应现象是解题关键.

练习册系列答案
相关题目
19.用NA表示阿佛加德罗常数,下列说法不正确的是( )
| A. | 标准状态下的辛烷22.4L完全燃烧产生CO2分子数为8NA | |
| B. | 18克水所含的电子数为10NA | |
| C. | 46克NO2和46克N2O4中所含原子数均为3NA | |
| D. | 1L2molL的Mg(NO3)2溶液中含NO3个数为4NA |
20.已知锌能溶解在NaOH溶液中,产生H2.某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6mol/L NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片用水冲洗、烘干后称量,得质量为m2.下列说法正确的是( )
| A. | 设锌镀层厚度为h,锌的密度为ρ,则$\frac{{{m_1}-{m_2}}}{ρS}$=h | |
| B. | 锌电极上发生还原反应 | |
| C. | 锌和石墨形成原电池,外电路中电流从锌流向石墨 | |
| D. | 当石墨不再产生气泡时,应立即取出铁皮 |
17.下列元素中,电负性最大的是( )
| A. | Cs | B. | O | C. | Be | D. | P |
4.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.5 L1mol/L NaHS溶液中,N(Na+)+N(HS-)=NA | |
| B. | 12.4g白磷(分子式为P4)中含有P-P共价键0.6NA | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA | |
| D. | 将92gN2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA |
14.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以上推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以上推测正确的是( )
| A. | 一定有SO32-离子 | B. | 不一定有CO32-离子 | ||
| C. | 不能确定Cl-离子是否存在 | D. | 不能确定HCO3-离子是否存在 |
1.短周期主族元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为19.X的简单阴离子比W的简单阴离子少2层电子,Y与Z位于相邻周期,Z的氧化物排放到空气中会形成酸雨.下列说法正确的是( )
| A. | 四种元素中,元素Z的非金属性最强 | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | Y、Z、W三种元素的原子半径大小顺序:r(W)>r(Z)>r(Y) | |
| D. | YW3、ZW2、Z2W2中各原子最外层均达到8电子稳定结构 |
19.对于放热反应Zn+H2SO4═ZnSO4+H2↑,下列叙述正确的是( )
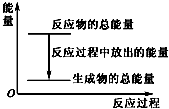

| A. | 反应过程中的能量关系可用如图表示 | |
| B. | 1 mol Zn的能量大于1 mol H2的能量 | |
| C. | 若将其设计为原电池,则锌作正极 | |
| D. | 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L |