题目内容
【题目】用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )

A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)<M(c) M(b)>M(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
【答案】A
【解析】
A. 该反应的正反应是个气体体积减小的放热反应。化学平衡向吸热方向移动。即化学平衡向逆反应方向移动。这时反应物的转化率降低。由图可看出:T3>T2> T1。所以Ka >Kb> Kc化学平衡常数只与温度有关,而与压强等无关。所以K(b)=K(d),故A正确;
B. 升高温度,不论是正反应速率还是逆反应速率都加快。故正反应速率:v(c)>v (a);在相同温度下,增大压强反应混合物的浓度增大,反应速率加快,由于压强b>d,v(b)>v(d),故B错误;
C.在相同压强下,温度升高,化学平衡向逆反应方向移动。,由于反应前后质量不变,但气体的物质的量增多故。平均摩尔质量:M(c)<M(a)在相同温度下,增大压强,化学平衡向气体体积减下的方向,即正反应方向移动, M(b)>M(d),故C错误;
D.反应时CO、H2是按照1:2反应的,所以平衡时a点可能有n(CO):n(H2)=1:2,也可能不是,故D错误;
答案选A。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】根据下列实验现象,所得结论错误的是
实验 | 实验现象 | 结论 |
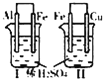
A |
| 活动性:Al>Fe>Cu |
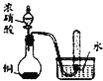
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.AB.BC.C
D.D