题目内容
15.化学反应H2+Cl2═2HCl的能量变化如图所示,则下列说法正确的是( )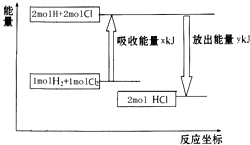
| A. | 该反应是放热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl 键放出x kJ能量 | |
| C. | 断裂1 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
分析 A.根据反应物与生成物具有能量的相对大小分析;
B.断键要吸收能量;
C.断裂2mol H-Cl键需要吸收y kJ的能量;
D.根据图中反应物与生成物能量高低分析.
解答 解:A.由图可知反应物的总能量大于生成物的总能量,所以该反应为放热反应,故A正确;
B.断键要吸收能量,所以断裂1mol H-H键和1mol Cl-Cl键吸收x kJ能量,故B错误;
C.由图可知,断裂2mol H-Cl键需要吸收y kJ的能量,故C错误;
D.由图可知反应物的总能量大于生成物的总能量,即2mol HCl的总能量低于1mol H2和1mol Cl2的总能量,故D错误;
故选A.
点评 主要是考查学生对反应热含义以及反应热计算的熟悉了解程度,旨在巩固学生的基础,提高学生的应试能力.明确反应热与反应物和生成物总能量的相对大小以及化学键变化时热量的变化是答题的关键,有利于培养学生的逻辑推理能力.

练习册系列答案
相关题目
5.下列实验可实现鉴别目的是( )
| A. | 用BaCl2溶液鉴别SO3(g)和SO2 | |
| B. | 用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 用CO2鉴别Na[Al(OH)4]溶液和Na2SiO3溶液 | |
| D. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
6.下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c (Na+)>c (HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
3.下列能说明乙醇分子中有一个氢原子与其他氢原子不同的是( )
| A. | 乙醇能燃烧 | |
| B. | 1molCH3CH2OH与Na完全反应只生成0.5molH2 | |
| C. | 乙醇分子中含有一个氧原子 | |
| D. | 乙醇能溶于水 |
10.下列物质的提纯或离子检验的方法正确的是( )
| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | 以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜 | |
| C. | 除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可 | |
| D. | 加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32- |
20.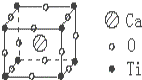 已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
 已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )| A. | CaTiO3 | B. | CaTiO6 | C. | Ca4TiO3 | D. | CaTiO12 |
7.下列关于同温同压下,同质量气体H2、D2、T2的叙述中,正确的是( )
①密度比1:2:3 ②质子数比6:3:2 ③中子数比0:3:4 ④体积比6:3:2.
①密度比1:2:3 ②质子数比6:3:2 ③中子数比0:3:4 ④体积比6:3:2.
| A. | ①②③④ | B. | ②③④ | C. | ①②③ | D. | ③④ |
4.金属钠应该保存在( )
| A. | 水中 | B. | 乙酸中 | C. | 煤油中 | D. | 乙醇中 |

 ;写出E与G反应生成H的结构简式是
;写出E与G反应生成H的结构简式是 .
.