题目内容
【题目】50 mL 0.50mol·L-1盐酸与50 mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。回答下列问题:
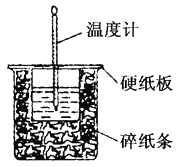
(1)小烧杯中发生反应的离子方程式为: ________________________________;
(2)该实验中反应发生过程中,温度计显示温度上升,说明该反应是__________反应(填”放热”或”吸热”)
(3)从能量的角度看,断开化学键要________________;形成化学键要_________________________;
(4)将实验中的药品换为铝片和稀盐酸,温度计显示温度上升。发生反应的化学方程式为______________________,反应物的总能量__________生成物的总能量(填”大于”或”小于”)
(5)目前,全球仍主要处于化石能源时期,下列有关能源说法正确的是__________;
A.煤、石油、天然气属于矿石能源,是取之不尽用之不竭的,可以大量使用
B.沼气的主要成分是甲醇,是一种清洁能源
C.太阳能、氢能、核能等以后将成为提供能源的重要形式
D.可利用风能发电来缓解枯水季节的电能不足
【答案】 OH一+ H+ = H2O; 放热 吸收能量 放出能量; 2Al+6HCl=2AlCl3+3H2 大于 CD
【解析】(1)小烧杯中发生反应的离子方程式为OH一+ H+=H2O;(2)该实验中反应发生过程中温度计显示温度上升,说明该反应是放热反应;(3)从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量;(4)将实验中的药品换为铝片和稀盐酸,温度计显示温度上升,发生反应的化学方程式为2Al+6HCl=2AlCl3+3H2↑。反应放热,因此反应物的总能量大于生成物的总能量;(5)A.煤、石油、天然气属于矿石能源,是不可再生的,A错误;B.沼气的主要成分是甲烷,B错误;C.太阳能、氢能、核能等以后将成为提供能源的重要形式,C正确;D.可利用风能发电来缓解枯水季节的电能不足,D正确,答案选CD。

 阅读快车系列答案
阅读快车系列答案【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与E形成的化合物的电子式是 ________。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是_________。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是______。
(4) F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是________________________________。
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素⑧中质子数和中子数相等的同位素符号是:____________;
(2)④、⑤、⑥的离子半径由大到小的顺序为:________________;
(3)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为:______________;
(4)④、⑤两种元素的原子按1:1组成的常见化合物,其阴、阳离子个数比为:__________;
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知:液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式___________________________。