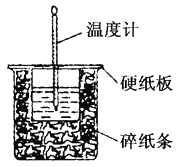
题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素⑧中质子数和中子数相等的同位素符号是:____________;
(2)④、⑤、⑥的离子半径由大到小的顺序为:________________;
(3)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为:______________;
(4)④、⑤两种元素的原子按1:1组成的常见化合物,其阴、阳离子个数比为:__________;
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知:液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,写出A与B反应的化学方程式___________________________。
【答案】 ![]() r(O2-)>r(Na+) >r(Al3+) NH3+HNO3=NH4NO3 1:2 N2H4+2H2O2=4H2O+N2
r(O2-)>r(Na+) >r(Al3+) NH3+HNO3=NH4NO3 1:2 N2H4+2H2O2=4H2O+N2
【解析】根据元素在周期表中的位置可以判断①~⑨号元素分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)元素⑧中质子数和中子数相等的同位素符号是![]() ;
;
(2)④、⑤、⑥的离子核外电子排布相同,它们的半径随原子序数的递增而减小,所以半径由大到小的顺序为r(O2-)>r(Na+) >r(Al3+) ;
(3)③的气态氢化物与其最高价氧化物对应水化物反应的化学方程式为NH3+HNO3=NH4NO3;
(4)④、⑤两种元素的原子按1:1组成的常见化合物为过氧化钠,化学式为Na2O2。过氧化钠是离子化合物,其阴离子为过氧根,其阳离子为钠离子,所以其阴、阳离子个数比为1:2 ;
(5)由表中两种元素形成的氢化物含有18个电子的有多种,如HCl、H2S、SiH4、C2H6、N2H4、H2O2,A是一种6原子分子,所以A是N2H4,它可做火箭发动机燃料;B是一种常见强氧化剂,则B为H2O2。A与B反应的化学方程式N2H4+2H2O2=4H2O+N2 。