题目内容
【题目】图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是
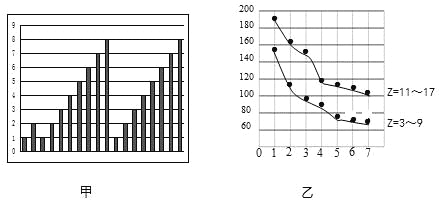
A. 图甲横坐标为原子序数,纵坐标表示元素的最高正价
B. 图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C. 图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D. 图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
【答案】D
【解析】试题分析:A.稀有气体化合价为0,氧元素、氟元素没有最高正化合价,图象中不符合,故A错误;B.同周期元素从左到右,主族元素原子半径逐渐减小,与图象不符,故B错误;C.氧元素、氟元素没有最高正化合价,图象中不符合,故C错误;D.同周期自左而右,主族元素最外层电子数由1-7,原子半径依次减小,图象符合实际,故D正确。

练习册系列答案
相关题目