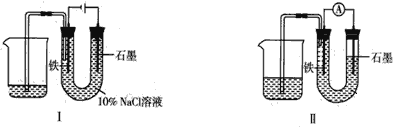
题目内容
【题目】加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
A.c(N2O5)=1.44 mol/L B.c(N2O5)=0.94 mol/L
C.c(N2O)=1.40 mol/L D.c(N2O)=3.48 mol/L
【答案】B
【解析】
试题分析:加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,则
N2O+O2,则
N2O5![]() N2O3+O2
N2O3+O2
开始 4 0 0
转化 x x x
平衡 4-x
N2O3![]() N2O+O2
N2O+O2
转化 y y y
平衡 x-y y x+y
化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则x+y=4.50、xy=1.62,解得x=3.06,y=1.44,c(N2O5)=(4-3.06)mol/L=0.94mol/L,c(N2O)=1.44mol/L,答案选B。

【题目】生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F—FZ§X§X§K] | N—F |
键能/ kJ·mol-1 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A. 过程N2(g)![]() 2N(g)放出能量
2N(g)放出能量
B. 过程N(g)+3F(g)![]() NF3(g)放出能量
NF3(g)放出能量
C. 反应N2(g)+3F2(g)![]() 2NF3(g)的ΔH>0
2NF3(g)的ΔH>0
D. NF3吸收能量后如果没有化学键的断裂与生成,仍能可能发生化学反应
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。
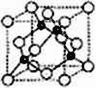
①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。