题目内容
13.下列化学反应的离子方程式正确的是( )| A. | 用小苏打(NaHCO3)治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| C. | 碳酸钠溶液与石灰乳的反应:CO32-+Ca2+═CaCO3↓ | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO4溶液2 H++SO42-+Ba2++2OH-=BaSO4↓+SO42-+2H2O |
分析 A.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水;
B.氢离子、氢氧根离子的系数不满足硫酸、氢氧化钡的化学式组成;
C.石灰乳中的氢氧化钙在离子方程式中不能拆开;
D.硫酸氢钠少量,离子方程式按照硫酸氢钠的化学式书写.
解答 解:A.小苏打(NaHCO3)治疗胃酸过多,反应实质为碳酸氢根离子与氢离子反应生成二氧化碳气体和水,反应的离子方程式为:HCO3-+H+═CO2↑+H2O,故A正确;
B.氢氧化钡与硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.碳酸钠溶液与石灰乳的反应,氢氧化钙不能拆开,正确的离子方程式为:CO32-+Ca(OH)2═CaCO3↓+Ca2+,故C错误;
D.Ba(OH)2溶液中加入少量的NaHSO4溶液,氢氧根离子过量,正确的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
4.在一定温度下,发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g).已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“<”、“>”或“=”)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1,CO的平衡转化率为60%.
(3)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正>v逆(填“<”、“>”或“=”),平衡向正向移动(填“正向”、“逆向”或“不移动”).
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
(1)该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“<”、“>”或“=”)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1,CO的平衡转化率为60%.
(3)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正>v逆(填“<”、“>”或“=”),平衡向正向移动(填“正向”、“逆向”或“不移动”).
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,5.6 L一氧化碳和5.6 L氧气混合后的分子总数为0.5NA | |
| B. | 标准状况下,5.6 L N2和16.8L NO混合气体中的原子数为2NA | |
| C. | 标准状况下,22.4L H2O中分子数为NA | |
| D. | 常温常压下,1 mol氦气含有的原子数为2NA |
8.已知25℃、101kPa条件下:①4Al(s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ/mol;
②4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1kJ/mol.由此得出的正确结论是( )
②4Al(s)+2O3(g)═2Al2O3(s)△H=-3119.1kJ/mol.由此得出的正确结论是( )
| A. | 等质量的O2比O3能量低,由O2变O3为放热反应 | |
| B. | 等质量的O2比O3能量高,由O2变O3为吸热反应 | |
| C. | O3比O2稳定,由O2变O3为放热反应 | |
| D. | O2比O3稳定,由O2变O3为吸热反应 |
2.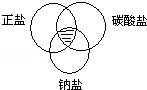 符合图中阴影部分的物质是( )
符合图中阴影部分的物质是( )
 符合图中阴影部分的物质是( )
符合图中阴影部分的物质是( )| A. | Na2CO3 | B. | BaSO4 | C. | MgCl2 | D. | NaHCO3 |
3.已知某元素+3价离子的电子排布式为:1s22s22p63s23p63d3,该元素在周期表中的位置和区是( )
| A. | 第三周期ⅥB族;p区 | B. | 第三周期ⅢB族;ds区 | ||
| C. | 第四周期ⅥB族;d区 | D. | 第四周期ⅢB族;f区 |